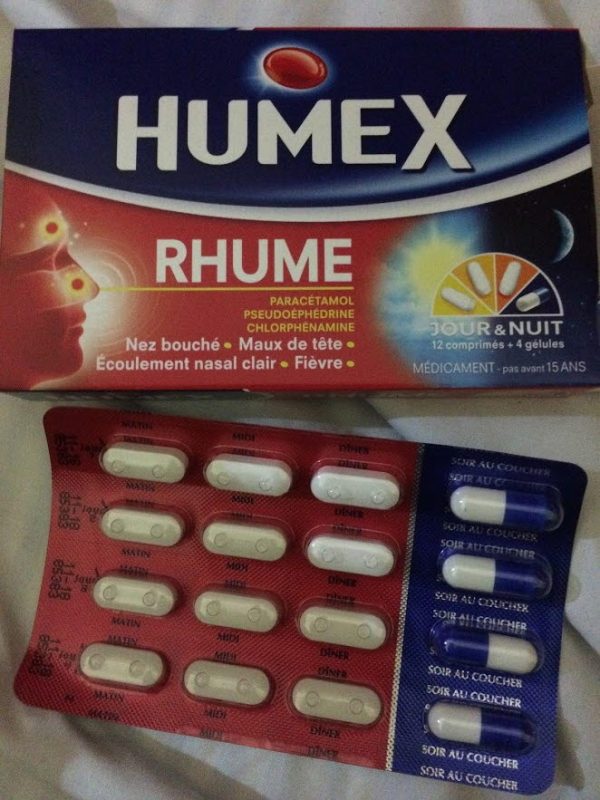
HUMEX RHUME cp/gél
Mise à jour : 12 Novembre 2019
Classification pharmacothérapeutique VIDAL :
Oto – Rhino – Laryngologie : Congestion nasale – Voie orale : Vasoconstricteurs (Vasoconstricteur + antihistaminique H1 + antipyrétique)
Classification ATC :
SYSTEME RESPIRATOIRE : PREPARATIONS POUR LE NEZ – DECONGESTIONNANTS A USAGE SYSTEMIQUE : SYMPATHOMIMETIQUES (PSEUDOEPHEDRINE EN ASSOCIATION)
| Paracétamol |
| Pseudoéphédrine chlorhydrate |
| Paracétamol |
| Chlorphénamine maléate |
Statut
Commercialisé
Excipients :
HUMEX RHUME cp : cellulose microcristalline, croscarmellose sel de Na, amidon prégélatinisé, magnésium stéarate, povidone K 30
HUMEX RHUME gél : talc, croscarmellose sel de Na, sodium laurylsulfate, silice colloïdale anhydre
Colorant (gélule) : érythrosine, indigotine, titane dioxyde
Enveloppe de la gélule : gélatine
| AMM | 3447463 |
|---|---|
| Présentation(s) | HUMEX RHUME Cpr/Gél Plq/16 |
| Conservation | |
| Non agréé aux Collectivités Remboursement : NR |
Formes et présentations
| FORMES et PRÉSENTATIONS |
Comprimé Jour (blanc) et gélule Nuit (bleue et blanche) : Boîte de 12 comprimés et 4 gélules, sous plaquette.
Composition
| COMPOSITION |
| Comprimé (pour le jour) : | p cp* |
| Paracétamol | 500 mg |
| Pseudoéphédrine chlorhydrate | 60 mg |
Excipients : cellulose microcristalline, amidon prégélatinisé, croscarmellose sodique, stéarate de magnésium, povidone K 30.
| Gélule (pour la nuit) : | p gélule** |
| Paracétamol | 500 mg |
| Chlorphénamine maléate | 4 mg |
Excipients : talc, croscarmellose sodique, laurylsulfate de sodium, silice colloïdale anhydre. Enveloppe de la gélule : tête (bleu transparent) : érythrosine, indigotine, gélatine ; corps (banc opaque) : dioxyde de titane, gélatine.
* Pour un comprimé de 700 mg.
** Pour une gélule n° 0 de 527 mg.
Indications
| DC | INDICATIONS |
Traitement au cours des rhumes de l'adulte et de l'adolescent de plus de 15 ans :
- des sensations de nez bouché,
- de l'écoulement nasal clair,
- des maux de tête et/ou fièvre.
Fertilité / grossesse / allaitement
| DC | FERTILITÉ/GROSSESSE/ALLAITEMENT |
La présence de pseudoéphédrine parmi les constituants conditionne la conduite à tenir pendant la grossesse et l'allaitement.
Grossesse :
Pour le paracétamol, une vaste quantité de données portant sur les femmes enceintes démontrent l'absence de toute malformation ou de toute toxicité fœtale/néonatale. Les études épidémiologiques consacrées au neurodéveloppement des enfants exposés au paracétamol in utero produisent des résultats non concluants.
Il n'y a pas de données fiables de tératogenèse chez l'animal.
En clinique, les études épidémiologiques n'ont pas mis en évidence d'effet malformatif lié à l'utilisation de la pseudoéphédrine.
Cependant, par mesure de prudence et compte tenu des puissantes propriétés vasoconstrictives de ce médicament, son utilisation est déconseillée pendant la grossesse.
Allaitement :
La pseudoéphédrine passe dans le lait maternel.
Compte tenu des possibles effets cardiovasculaires et neurologiques des vasoconstricteurs, la prise de ce médicament est contre-indiquée pendant l'allaitement.
Conduite et utilisation de machines
| DC | CONDUITE et UTILISATION DE MACHINES |
L'attention est appelée, notamment chez les conducteurs de véhicules et les utilisateurs de machines, sur les risques de somnolence attachés à l'emploi de ce médicament, surtout en début de traitement.
Ce phénomène est accentué par la prise de boissons alcoolisées ou de médicaments contenant de l'alcool.
Surdosage
| DC | SURDOSAGE |
Lié à la pseudoéphédrine :
Le surdosage en pseudoéphédrine peut entraîner : accès hypertensif, troubles du rythme, convulsions, délire, hallucinations, agitation, troubles du comportement, insomnie, mydriase, accident vasculaire cérébral.
Lié à la chlorphénamine :
Le surdosage en chlorphénamine peut entraîner : convulsions (surtout chez l'enfant), troubles de la conscience, coma.
Lié au paracétamol :
L'intoxication est à craindre chez les sujets âgés et surtout chez les jeunes enfants (surdosage thérapeutique ou intoxication accidentelle fréquente) chez qui elle peut être mortelle.
Symptômes :
Nausées, vomissements, anorexie, pâleur, douleurs abdominales apparaissent généralement dans les 24 premières heures.
Un surdosage, à partir de 10 g de paracétamol en une seule prise chez l'adulte et 150 mg/kg de poids corporel en une seule prise chez l'enfant, provoque une cytolyse hépatique susceptible d'aboutir à une nécrose complète et irréversible se traduisant par une insuffisance hépatocellulaire, une acidose métabolique, une encéphalopathie pouvant aller jusqu'au coma et à la mort.
Simultanément, on observe une augmentation des transaminases hépatiques, de la lacticodéshydrogénase, de la bilirubine et une diminution du taux de prothrombine pouvant apparaître 12 à 48 heures après l'ingestion.
Conduite d'urgence :
- Transfert immédiat en milieu hospitalier.
- Prélever un tube de sang pour faire le dosage plasmatique initial du paracétamol.
- Évacuation rapide du produit ingéré, par lavage gastrique.
- Acidifier les urines en donnant du chlorure d'ammonium (pour augmenter l'élimination de la pseudoéphédrine).
- Le traitement du surdosage comprend classiquement l'administration aussi précoce que possible de l'antidote N-acétylcystéine par voie IV ou voie orale si possible avant la 10e heure.
- Traitement symptomatique.
Pharmacodynamie
| PP | PHARMACODYNAMIE |
Classe pharmacothérapeutique : Décongestionnants à usage systémique, code ATC : R01BA52.
Ce médicament associe un antalgique (le paracétamol), un antihistaminique (la chlorphénamine), et un vasoconstricteur (la pseudoéphédrine).
Pharmacocinétique
| PP | PHARMACOCINÉTIQUE |
Paracétamol :
Absorption :
L'absorption du paracétamol par voie orale est complète et rapide. Les concentrations plasmatiques maximales sont atteintes 30 à 60 minutes après ingestion.
Distribution :
Le paracétamol se distribue rapidement dans tous les tissus. Les concentrations sont comparables dans le sang, la salive et le plasma. La liaison aux protéines plasmatiques est faible.
Métabolisme :
Le paracétamol est métabolisé essentiellement au niveau du foie. Les 2 voies métaboliques majeures sont la glycuroconjugaison et la sulfoconjugaison. Cette dernière voie est rapidement saturable aux posologies supérieures aux doses thérapeutiques. Une voie mineure, catalysée par le cytochrome P450, est la formation d'un intermédiaire réactif (le N-acétyl benzoquinone imine) qui, dans les conditions normales d'utilisation, est rapidement détoxifié par le glutathion réduit et éliminé dans les urines après conjugaison à la cystéine et à l'acide mercaptopurique. En revanche, lors d'intoxications massives, la quantité de ce métabolite toxique est augmentée.
Élimination :
L'élimination est essentiellement urinaire. 90 % de la dose ingérée est éliminée par le rein en 24 heures, principalement sous forme glycuroconjuguée (60 à 80 %) et sulfoconjuguée (20 à 30 %). Moins de 5 % est éliminé sous forme inchangée.
La demi-vie d'élimination est d'environ 2 heures.
Variations physiopathologiques :
- Insuffisance rénale : en cas d'insuffisance rénale sévère (clairance de la créatinine inférieure à 10 ml/min), l'élimination du paracétamol et de ses métabolites est retardée.
- Sujet âgé : la capacité de conjugaison n'est pas modifiée.
Pseudoéphédrine :
Après administration par voie orale, la pseudoéphédrine est excrétée essentiellement par voie rénale sous forme inchangée (70 à 90 %).
Sa demi-vie d'élimination est dépendante du pH urinaire.
L'alcalinisation des urines entraîne une augmentation accrue de la réabsorption tubulaire, avec, pour conséquence, un allongement de la demi-vie d'élimination de la pseudoéphédrine.
Chlorphénamine :
La chlorphénamine est bien absorbée au niveau du tube digestif. Sa demi-vie plasmatique est de 12 à 15 h environ. Elle est éliminée essentiellement par voie rénale.
Sécurité préclinique
| PP | SÉCURITÉ PRÉCLINIQUE |
Aucune étude conventionnelle s'appuyant sur les normes actuellement admises pour évaluer la toxicité pour la reproduction et le développement n'est disponible.
Modalités de conservation
| DP | MODALITÉS DE CONSERVATION |
Durée de conservation :
3 ans.
A conserver à l'abri de l'humidité.
Modalités manipulation / élimination
| DP | MODALITÉS MANIPULATION/ÉLIMINATION |
Pas d'exigences particulières.
Prescription / délivrance / prise en charge
| PRESCRIPTION/DÉLIVRANCE/PRISE EN CHARGE |
| AMM | 3400934474637 (1997, RCP rév 11.07.2019). |
| Non remb Séc soc. |
Médicament(s) proche(s)
| Désignation | Liste | % Remb | Type |
|---|---|---|---|
| Il n'y a pas de produit équivalent identifié | |||