P = prescription médicale obligatoire
ANSM – Mis à jour le : 16/08/2017
FOSTIMONKIT 300 UI poudre et solvant pour solution injectable
Urofollitropine
Veuillez lire attentivement cette notice avant d’utiliser ce médicament car elle contient des informations importantes pour vous.
· Gardez cette notice. Vous pourriez avoir besoin de la relire.
· Si vous avez d’autres questions, interrogez votre médecin ou votre pharmacien.
· Ce médicament vous a été personnellement prescrit. Ne le donnez pas à d’autres personnes. Il pourrait leur être nocif, même si les signes de leur maladie sont identiques aux vôtres.
· Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Voir rubrique 4.
1. Qu'est-ce que FOSTIMONKIT et dans quels cas est-il utilisé ?
2. Quelles sont les informations à connaître avant d'utiliser FOSTIMONKIT ?
3. Comment utiliser FOSTIMONKIT ?
4. Quels sont les effets indésirables éventuels ?
5. Comment conserver FOSTIMONKIT ?
6. Contenu de l’emballage et autres informations.
Classe pharmacothérapeutique – Gonadotrophines ; code ATC : G03GA04
FOSTIMONKIT 300 UI, poudre et solvant pour solution injectable est indiqué pour provoquer l'ovulation chez des femmes qui n'ovulent pas et qui n'ont pas répondu au traitement par le citrate de clomifène.
FOSTIMONKIT 300 UI, poudre et solvant pour solution injectable est indiqué pour stimuler la croissance de plusieurs follicules (et par conséquent de plusieurs œufs) chez des femmes ayant recours à un traitement pour la fertilité.
L’urofollitropine est une hormone folliculo-stimulante humaine hautement purifiée, appartenant au groupe pharmacothérapeutique des gonadotrophines. Ce médicament doit être utilisé sous surveillance médicale.
Votre fertilité et celle de votre partenaire devront avoir été évaluées avant de commencer le traitement.
N’utilisez jamais FOSTIMONKIT dans les situations suivantes :
·Si vous êtes allergique à la substance active ou à l’un des autres composants contenus dans ce médicament, mentionnés dans la rubrique 6.
·Ovaires hypertrophiés ou kystes non imputables à un syndrome des ovaires polykystiques.
·Saignements dont la cause est inconnue.
·Cancer de l'ovaire, de l'utérus ou du sein.
·Tumeur de l'hypophyse ou de l'hypothalamus.
Ce médicament ne doit pas être administré dans les cas où une grossesse est impossible tels que ménopause précoce, malformations des organes génitaux ou tumeurs spécifiques de l'utérus.
Avertissements et précautions
Adressez-vous à votre médecin ou pharmacien avant d’utiliser FOSTIMONKIT.
Même si aucune réaction allergique n’a été rapportée sous FOSTIMONKIT, veuillez informer votre médecin de toute réaction allergique survenue avec un médicament similaire.
Ce traitement accroît le risque de développer un syndrome d'hyperstimulation ovarienne (SHO) (se reporter au paragraphe 4). Si un syndrome d’hyperstimulation ovarienne non souhaité survenait, votre traitement serait interrompu et toute grossesse devrait être évitée. Les premiers signes d’une hyperstimulation ovarienne sont une douleur dans la région abdominale basse ainsi que des nausées, vomissements et prise de poids. Si ces symptômes apparaissent vous devez consulter votre médecin dès que possible. Dans certains cas, rares mais graves, une hypertrophie des ovaires et d’épanchements de liquide dans l’abdomen ou la cage thoracique peut survenir.
Le médicament utilisé pour la maturation folliculaire finale et l’ovulation (contenant des gonadotrophines chorioniques humaines – hCG) peut augmenter le risque de développer un SHO. Il est donc déconseillé d’utiliser de la hCG lors de la survenue d’un SHO, et vous ne devez pas avoir de rapports sexuels, même si un moyen de contraception mécanique (préservatif) est utilisé, pendant au minimum 4 jours.
Les taux de fausse couche spontanée sont plus élevés chez les femmes présentant des problèmes de fertilité que dans la population générale.
Chez les patientes recevant un traitement induisant l’ovulation, l’incidence des grossesses et des naissances multiples est accrue, comparée à la conception naturelle. Toutefois, ce risque peut être réduit en utilisant des doses et le schéma d’administration recommandés.
Chez les femmes présentant une anomalie des trompes de Fallope, il y a une augmentation du risque de grossesse extra-utérine.
Les grossesses multiples et les caractéristiques des parents suivant un traitement pour la fertilité (ex : âge de la mère, caractéristiques du sperme) peuvent être associés à un risque accru d’anomalies congénitales.
Le traitement avec FOSTIMONKIT, tout comme la grossesse en-soi, peut augmenter le risque de thrombose. La thrombose est la formation de caillots sanguins dans un vaisseau, la plupart du temps dans une veine de la jambe ou des poumons.
En particulier, vous devez en discuter avec votre médecin dans les cas suivants :
·Si vous êtes au courant d’une prédisposition aux thromboses
·Si vous, ou un membre de votre famille, a déjà eu une thrombose
·Si vous êtes en surpoids important.
Ce médicament est préparé à partir d’urine humaine. Le risque de transmission d’agents qui pourraient causer une infection ou une maladie ne peut pas être définitivement exclu. Ce risque est cependant limité par les étapes de fabrication permettant d’éliminer les virus, notamment pour le VIH, les Herpès virus et les Papillomavirus.
Aucun cas de contamination virale n’a jamais été rapporté.
Enfants
Sans objet.
Autres médicaments et FOSTIMONKIT
Informez votre médecin ou pharmacien si vous prenez, avez récemment pris ou pourriez prendre tout autre médicament.
FOSTIMONKIT avec des aliments, boissons et de l’alcool
Sans objet.
FOSTIMONKIT ne doit pas être utilisé si vous êtes enceinte ou si vous allaitez.
Demandez conseil à votre médecin ou à votre pharmacien avant de prendre tout médicament.
Conduite de véhicules et utilisation de machines
Sans objet.
FOSTIMONKIT contient {nommer le/les excipient (s)}
Sans objet.
3. COMMENT UTILISER FOSTIMONKIT 300 UI, poudre et solvant pour solution injectable ?
La dose recommandée est de :
Respectez toujours la posologie indiquée par votre médecin. En cas de doute, consultez votre médecin.
Patientes qui n’ovulent pas et qui ont des règles irrégulières ou qui n’ont pas de règles :
Si vous avez vos règles, le traitement doit commencer dans les 7 jours suivant l'apparition des règles (7 premiers jours du cycle menstruel).
Vous recevrez 1 injection par jour, sous la peau (injection sous-cutanée). Le schéma thérapeutique standard commence avec 75 à 150 UI des FSH (FOSTIMONKIT) chaque jour.
Cette dose peut-être (si nécessaire) augmentée de 37,5 à 75 UI à 7 jours ou de préférence à 14 jours d'intervalle, afin d'obtenir une réponse adéquate.
La dose quotidienne maximale de FSH n’est, en général, pas supérieure à 225 UI.
Si votre médecin ne constate aucune réponse après 4 semaines, le traitement doit, pour ce cycle, être abandonné. Votre médecin vous prescrira, pour le cycle suivant, un traitement avec une dose de départ plus élevée.
Lorsqu’une réponse optimale est obtenue (croissance folliculaire satisfaisante), un autre médicament (hGC) vous sera injecté en dose unique pour déclencher la maturation folliculaire finale et l’ovulation. Ce médicament sera administré 24 à 48 heures après la dernière injection de FOSTIMONKIT. Vous devrez avoir un rapport sexuel le jour même de l’administration d’hCG et le lendemain.
Si une réponse excessive est obtenue, le traitement doit être arrêté et l'hCG ne doit pas être administrée. Votre médecin vous prescrira pour le cycle suivant une posologie inférieure.
Stimulation ovarienne avant une Fécondation In Vitro ou d’autres techniques d’Assistance Médicale à la Procréation :
Situation 1
Si vous avez vos règles, le traitement doit commencer dans les 2 à 3 jours suivant l’apparition des règles (2 à 3 premiers jours du cycle menstruel).
Le traitement consiste en une injection par jour en sous cutanée.
Le schéma thérapeutique standard destiné à provoquer une super ovulation, comprend l’administration de 150 à 225 UI de FOSTIMONKIT par jour. Le traitement sera poursuivi en ajustant la posologie, en fonction de votre réponse, jusqu’à l’obtention d’une croissance folliculaire adéquate (déterminée par un contrôle sanguin et/ou une échographie). La croissance folliculaire adéquate est généralement obtenue après, en moyenne, 10 jours de traitement (entre 5 et 20 jours).
La posologie maximale est en général de 450 UI/jour.
Une fois la croissance folliculaire adéquate obtenue, une injection unique d’un médicament utilisé pour déclencher la maturation finale contenant jusqu’à 10 000 UI de gonadotrophine chorionique humaine (hCG) sera alors administrée 24 à 48 heures après la dernière injection de FOSTIMONKIT.
Les ovocytes seront ponctionnés environ 35 heures plus tard.
Situation 2
Lorsqu’une désensibilisation avec un agoniste de la GnRH est utilisée, FOSTIMONKIT est administré environ 2 semaines après le début du traitement par l’agoniste. Les deux traitements sont poursuivis jusqu’à obtention d’une croissance folliculaire adéquate.
Le traitement par FOSTIMONKIT consiste en une injection par jour en sous-cutanée.
A titre d’exemple, après 2 semaines de traitement par l’agoniste de la GnRH, 150 à 225 UI de FOSTIMONKIT seront administrées durant les 7 premiers jours. La dose sera ensuite ajustée en fonction de la réponse ovarienne.
Mode d’administration
Comment administrer FOSTIMONKIT ?
FOSTIMONKIT est injecté lentement dans la peau (voie sous-cutanée).
Chaque flacon est à usage unique et doit être administré immédiatement après reconstitution.
Votre médecin peut vous demander de vous administrer FOSTIMONKIT par vous-même.
Pour la première fois votre médecin doit :
·vous avoir fait pratiquer une injection sous-cutanée,
·vous avoir indiqué les zones d’injection possibles,
·vous avoir montré comment préparer la solution à injecter,
·vous avoir indiqué précisément comment préparer la bonne dose à injecter.
Avant de vous injecter vous-même FOSTIMONKIT, lisez attentivement les instructions suivantes :Modalités de reconstitution et d'injection d'1 flacon de FOSTIMONKIT, en utilisant 1 flacon de poudre :
La solution à injecter doit être préparée juste avant l'injection. Un flacon est à usage unique. Le produit doit être reconstitué sous conditions aseptiques.
FOSTIMONKIT ne doit être reconstitué qu’avec le solvant fourni dans l’emballage.
Préparez une surface de travail propre et lavez-vous les mains avant la reconstitution de la solution. Il est important que vos mains et les accessoires que vous utilisez soient aussi propres que possible.
Placez sur la surface propre tous les accessoires suivants:
·deux cotons imbibés d'alcool (non fournis),
·un flacon contenant la poudre de FOSTIMONKIT
·une seringue pré-remplie de solvant,
·une aiguille pour la reconstitution de la solution à injecter,
·une aiguille fine pour l'injection sous-cutanée.
Reconstitution de la solution à injecter en utilisant 1 flacon de poudre
Préparez la solution à injecter :
|
|
|
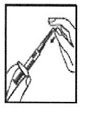
1- Retirez le capuchon de la seringue pré-remplie, montez l’aiguille pour reconstitution (aiguille longue) sur la seringue. Posez précautionneusement la seringue sur une surface de travail propre. Evitez de toucher l’aiguille. |
|
|
2 – Retirez le capuchon plastique coloré du flacon contenant la poudre en le soulevant doucement. Désinfectez la surface du bouchon en caoutchouc en l’essuyant avec un coton imbibé d'alcool et laissez sécher. |
|
|
|
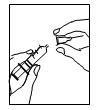
3 – Prenez votre seringue, retirez le capuchon protecteur de l’aiguille et injectez doucement le solvant dans le flacon de poudre à travers le milieu du dessus du capuchon en caoutchouc. Appuyez fermement sur le piston pour faire descendre toute la solution dans la poudre. Un dispositif back-stop est ajusté sur la collerette de la seringue pour empêcher le retrait par inadvertance du piston du tube de la seringue et pour améliorer le maintien de la seringue au moment de l’injection. NE PAS SECOUER mais faire doucement rouler le flacon entre vos doigts jusqu’à dissolution complète de la poudre, en prenant soin d’éviter la formation de mousse. |
|
|
|
4 – Une fois la poudre dissoute (ce qui habituellement se produit immédiatement), aspirez doucement la solution dans la seringue : Avec la seringue toujours en place, retournez le flacon tête en bas – Assurez-vous que l’extrémité de l’aiguille est bien recouverte par le liquide. – Tirez doucement sur le piston afin d’aspirer toute la solution. – Vérifiez que la solution reconstituée est claire et incolore. |
|
Préparation de doses plus élevées en utilisant plus d’un flacon de poudre
Si votre médecin vous a recommandé des doses plus élevées, vous devez utiliser plus d’un flacon de poudre avec une seringue préremplie de solvant.
Pour reconstituer plus d’un flacon de FOSTIMONKIT, à la fin de l’étape 4 ci-dessus, prélevez à nouveau avec la seringue le contenu reconstitué du premier flacon et injectez-le lentement dans un second flacon en répétant les étapes 2 à 4 ci-dessus. Répétez jusqu’à ce que le contenu du nombre de flacons correspondant au dosage prescrit soit dissous (dans la limite du dosage maximum total de 450 UI, correspondant à un maximum de 6 flacons pour FOSTIMONKIT 75 UI, 3 flacons de FOSTIMONKIT 150 UI ou 2 flacons de FOSTIMONKIT 225 UI).
Votre docteur peut augmenter votre dose de 37,5 UI, ce qui représente la moitié d’un flacon de FOSTIMONKIT 75 UI.
Pour cela vous devez reconstituer le contenu d’un flacon de 75 UI selon les étapes 2 et 3 décrites ci-dessus et prélever la moitié de la solution reconstituée (0,5 ml) avec la seringue selon l’étape 4.
Dans cette situation vous aurez 2 préparations à injecter : la première préparation reconstituée dans 1 ml et la seconde contenant 37,5 UI dans 0,5 ml.
Les deux préparations seront injectées avec leur propre seringue selon les étapes suivantes.
La solution doit être claire et incolore.
Injection de la solution en sous-cutanée :
|
|
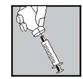
Lorsque la seringue contient la dose prescrite, remettez le capuchon protecteur sur l’aiguille. Remplacez l'aiguille utilisée pour la préparation par l’aiguille fine pour injection sous-cutanée avec son capuchon protecteur. Poussez fermement l'aiguille fine contre le réservoir de la seringue, puis tournez-le légèrement pour s’assurer qu’il est bien vissé et pour créer un joint ferme. |
|
|
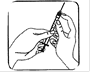
Retirez le capuchon protecteur de l’aiguille. Dirigez l’aiguille vers le haut puis tapotez légèrement la seringue de façon à ce que les bulles remontent. Appuyez doucement sur le piston jusqu’à ce qu’un peu de liquide apparaisse en haut de l’aiguille. Ne pas utiliser si le liquide est trouble ou contient des particules. |
Site d’injection :
Votre médecin ou votre infirmière vous aura déjà indiqué où injecter votre médicament sur votre corps. Généralement les endroits sont la cuisse ou le ventre en-dessous du nombril. Désinfectez la zone où l'injection va être faite avec un coton imbibé d'alcool.
Insertion de l’aiguille :
|
|
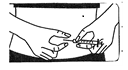
Pincez fermement la peau entre vos doigts. De l’autre main enfoncez l'aiguille d'un coup sec avec un angle de 45 ou 90 degrés. |
Injecter la solution :
Injectez sous la peau comme on vous l'a indiqué. N'injectez pas directement dans une veine. Appuyez doucement et fermement sur le piston afin d’injecter correctement la solution et pour éviter d’abîmer les tissus.
Prenez tout le temps nécessaire pour injecter le volume de solution prescrite. Comme décrit dans la préparation de la solution, en fonction de la dose prescrite par votre médecin vous pouvez ne pas utiliser toute la solution.
Retrait de l’aiguille :
Retirez immédiatement l’aiguille et appuyez avec un coton imbibé d’alcool au point d’injection.
Un massage doux – en maintenant la pression – aide à disperser la solution de FOSTIMONKIT et à soulager tout inconfort.
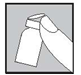
Jetez tous les accessoires utilisés:
Tout médicament non utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur (une fois l’injection terminée, toutes les aiguilles et seringues vides doivent être immédiatement jetées dans un récipient prévu à cet effet).
Utilisation chez les enfants
Sans objet.
Si vous avez utilisé plus de FOSTIMONKIT que vous n’auriez dû
Les effets d'un surdosage avec FOSTIMONKIT ne sont pas connus, néanmoins, un syndrome d'hyperstimulation ovarienne n'est pas exclu (se reporter au paragraphe 2). Si vous avez utilisé plus de FOSTIMONKIT que vous n’auriez dû, consultez immédiatement votre médecin ou votre pharmacien.
Si vous oubliez de prendre FOSTIMONKIT
Prenez-le comme prévu au moment de l’injection suivante. Ne prenez pas de dose double pour compenser la dose simple que vous avez oublié de prendre.
Si vous arrêtez de prendre FOSTIMONKIT N’arrêtez pas FOSTIMONKIT de votre propre initiative : si vous souhaitez arrêter le traitement, il faut toujours consulter votre médecin.Si vous avez d’autres questions concernant l’utilisation de ce médicament, demandez plus d’informations à votre médecin ou votre pharmacien.
4. QUELS SONT LES EFFETS INDESIRABLES EVENTUELS ?
L’effet indésirable suivant est important et nécessitera une action immédiate si vous le ressentez. Vous devez arrêter la prise de FOSTIMONKIT et voir votre médecin immédiatement dans la situation suivante :
·Fréquents (de 1 à 10 patients sur 100) : syndrome d'hyperstimulation ovarienne (se référer au paragraphe 2 pour des informations supplémentaires),
·Fréquents (de 1 à 10 patients sur 100) : maux de tête, ballonnements, constipation, et douleur au point d'injection.
· Peu fréquents (de 1 à 10 patients sur 1000) : augmentation de l’activité de la glande thyroïde, sautes d’humeur, fatigue, dyspnée, saignement de nez, nausées, indigestion, douleurs abdominales, rougeur, démangeaison, bouffées de chaleur, cystite, gonflement des seins, douleur aux seins, augmentation du temps de saignement.
Rougeurs, douleurs et autres réactions locales au site d’injection peuvent survenir.
Se référer à la section 2 pour les risques de caillots sanguins, de grossesse extra-utérine, de grossesse multiple et de fausse couche.
Si vous remarquez des effets indésirables non mentionnés dans cette notice, ou si certains effets indésirables deviennent graves, veuillez en informer votre médecin ou pharmacien.
Déclaration des effets secondaires
Si vous ressentez un quelconque effet indésirable, parlez-en à votre médecin ou votre pharmacien. Ceci s’applique aussi à tout effet indésirable qui ne serait pas mentionné dans cette notice. Vous pouvez également déclarer les effets indésirables directement via le système national de déclaration : Agence nationale de sécurité du médicament et des produits de santé (ANSM) et réseau des Centres Régionaux de Pharmacovigilance – Site internet: www.ansm.sante.fr
En signalant les effets indésirables, vous contribuez à fournir davantage d’informations sur la sécurité du médicament.
5. COMMENT CONSERVER FOSTIMONKIT 300 UI, poudre et solvant pour solution injectable ?
Tenir ce médicament hors de la vue et de la portée des enfants.
N’utilisez pas ce médicament après la date de péremption indiquée sur le carton, le flacon et la seringue préremplie. La date de péremption fait référence au dernier jour de ce mois.
A conserver à une température ne dépassant pas +25°C. Conserver le flacon et la seringue préremplie dans l’emballage extérieur, à l’abri de la lumière.
A utiliser immédiatement après reconstitution.
N’utilisez pas ce médicament si vous remarquez que la solution n’est pas claire. Après reconstitution la solution doit être claire et incolore.
Ne jetez aucun médicament au tout-à-l’égout ni avec les ordures ménagères. Demandez à votre pharmacien d’éliminer les médicaments que vous n’utilisez plus. Ces mesures contribueront à protéger l’environnement.
6. CONTENU DE L’EMBALLAGE ET AUTRES INFORMATIONS
·La substance active est :
Urofollitropine……………………………………………………………………………………………………. 300 UI
Un flacon contient 300 UI d’urofollitropine (hormone folliculo-stimulante FSH) : 1 ml de solution reconstituée contient 300 UI d’urofollitropine.
L’activité spécifique in vivo égale ou supérieure à 5000 IU de FSH par mg de protéine.
·Les autres composants sont :
o Pour la poudre : lactose monohydraté.
o Pour le solvant : chlorure de sodium et eau pour préparations injectables
Qu’est-ce que FOSTIMONKIT et contenu de l’emballage extérieur
FOSTIMONKIT se présente sous forme d’une poudre et d’un solvant pour solution injectable. 1 étui contient une poudre en flacon (300 UI), un solvant dans une seringue préremplie (1 ml), une aiguille pour reconstitution et une aiguille pour injection sous-cutanée – Boîte de 1, 5 ou 10 étuis.
La poudre est une masse blanche à blanchâtre et le solvant est clair et incolore.
Toutes les présentations peuvent ne pas être commercialisées.
Titulaire de l’autorisation de mise sur le marché
280 rue de Goa
Zone industrielle les trois moulins
Parc de Sophia-Antipolis
06600 ANTIBES
Exploitant de l’autorisation de mise sur le marché
Laboratoires Genévrier
280 rue de Goa
Zone industrielle les trois moulins
Parc de Sophia-Antipolis
06600 ANTIBES
280 rue de Goa
Zone industrielle les trois moulins
Parc de Sophia-Antipolis
06600 ANTIBES
Ou IBSA FARMACEUTICI ITALIA S.r.LVIA MARTIRI DI CEFALONIA 26900 LODI (LO)ITALIE
Noms du médicament dans les Etats membres de l'Espace Economique Européen
Conformément à la réglementation en vigueur.
La dernière date à laquelle cette notice a été révisée est :
{MM/AAAA}
Des informations détaillées sur ce médicament sont disponibles sur le site Internet de l’ANSM (France).