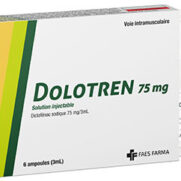
Dolotren® 75 mg solution injectable
1 – DÉNOMINATION DU MEDICAMENT
Dolotren® 75 mg solution injectable.
2 – COMPOSITION QUALITATIVE ET QUANTITATIVE
Chaque ampoule contient 75 mg de diclofénac sodique.
Excipients avec effet connu :
Chaque ampoule contient :
- 93,96 mg d’alcool benzylique ;
- 3 mg de métabisulfite de sodium (E- 223) ;
- 621,6 mg de propylèneglycol ;
- 7,37 mg de sodium (provenant de diclofénac sodique, métabisulfite sodique et hydroxide sodique).
Pour la liste complète des excipients, voir rubrique 6.1
3 – FORME PHARMACEUTIQUE
Solution injectable avec une concentration de 78,58 mmol/L et pH entre 8,3 – 8,7.
Solution aqueuse transparente et incolore ou légèrement jaunâtre, sans particules étrangères.
4 – DONNÉES CLINIQUES
4.1 Indications thérapeutiques
Traitement symptomatique de la douleur aiguë intense associée à :
- Arthrite rhumatoïde ;
- Spondylarthrite ankylosante ;
- Arthrose ;
- Rhumatisme extra-articulaire ;
- Colique néphrétique ;
- Crise de goutte aiguë ;
- Douleur lombaire ;
- Douleur musculosquelettique ;
- Douleur postopératoire et post-traumatique.
4.2 Posologie et mode d’administration
La recommandation générale est d’ajuster individuellement la dose en fonction de la réponse du patient. Les effets indésirables peuvent être minimisés en utilisant la dose efficace la plus faible pendant la période de traitement la plus courte possible pour maîtriser les symptômes (voir rubrique 4.4. Mises en garde spéciales et précautions d’emploi).
Posologie
Adultes
75 mg (1 ampoule) une fois par jour.
Exceptionnellement, et pour des cas graves, on peut administrer deux injections par jour séparées par un intervalle de plusieurs heures.
Le diclofénac injectable ne doit pas être administré pendant plus de deux jours. Après contrôle de la crise aiguë, continuer le traitement au diclofénac avec des comprimés ou suppositoires.
Si on combine l’administration d’une ampoule avec d’autres formes pharmaceutiques, le dosage ne devra pas dépasser 150 mg/jour.
Population spéciale
Population pédiatrique
En raison de la dose de Dolotren® 75 mg solution injectable l’ampoule n’est pas recommandée pour être utilisée chez les enfants et les adolescents.
Personnes âgées (plus de 65 ans)
La pharmacocinétique du diclofénac 50 mg ne subit pas de modifications chez les patients âgés ; par conséquent, il n’est pas nécessaire de modifier la dose et la fréquence d’administration.
Cependant, comme avec tout autre médicament anti-inflammatoire non stéroïdien, il convient d’administrer avec prudence le diclofénac chez ces patients qui sont généralement plus sujets aux effets indésirables et ont plus de probabilité de présenter des altérations cardiovasculaires et de la fonction rénale ou hépatique, ainsi que de recevoir un traitement concomitant. Plus précisément, il est recommandé d’utiliser la dose efficace minimale chez ces patients.
Patients présentant une altération rénale
Le diclofénac est contre-indiqué chez les patients souffrant d’une insuffisance rénale grave (voir rubrique 4.3). Aucune étude spécifique n’a été réalisée chez les patients souffrant d’une insuffisance rénale ; aucune recommandation relative à l’ajustement de la dose ne peut donc être faite.
La prudence est recommandée lors de l’administration du diclofénac chez les patients souffrant d’une insuffisance rénale légère à modérée (voir rubrique 4.4).
Patients présentant une altération hépatique
Le diclofénac est contre-indiqué chez les patients souffrant d’une insuffisance hépatique grave (voir rubrique 4.3). Aucune étude spécifique n’a été réalisée chez les patients souffrant d’une insuffisance hépatique ; aucune recommandation relative à l’ajustement de la dose ne peut donc être faite.
La prudence est recommandée lors de l’administration du diclofénac chez les patients souffrant d’une insuffisance hépatique légère à modérée (voir rubrique 4.3 et 4.4).
Mode d’administration
Dolotren® 75 mg solution injectable est administré par voie intramusculaire par injection intrafesse profonde, dans le quadrant supérieur externe.
4.3 Contre-indications
Dolotren® 75 mg solution injectable ne doit pas être administré dans les cas suivants :
- Patients présentant une hypersensibilité connue au diclofénac ou à l’un des excipients mentionnés à la rubrique 6.1. ;
- Comme d’autres anti-inflammatoires non stéroïdiens (AINS), le diclofénac est également contre-indiqué chez les patients chez lesquels l’administration d’acide acétylsalicylique ou d’autres AINS a déclenché des crises d’asthme, une urticaire ou une rhinite aiguë (voir rubrique 4.4 et 4.8) ;
- Patients souffrant d’une maladie de Crohn active ;
- Patients souffrant d’une colite ulcéreuse active ;
- Patients souffrant d’une insuffisance rénale grave (voir rubrique 4.4) ;
- Patients souffrant d’une insuffisance hépatique grave (voir rubrique 4.4) ;
- Patients présentant des troubles de la coagulation (voir rubrique 4.4) ;
- Antécédents d’hémorragie gastro-intestinale ou de perforation liée à des traitements antérieurs par des anti-inflammatoires non stéroïdiens (AlNS) (voir rubrique 4.4) ;
- Ulcère peptique/hémorragie gastro-intestinale ;
- Insuffisance cardiaque congestive avérée (stade li-IV de la classification NYHA), cardiopathie ischémique, artériopathie périphérique et/ou maladie cérébrovasculaire ;
- Femmes enceintes au cours du troisième trimestre de la grossesse (voir rubrique 4.4).
4.4 Mises en garde spéciales et précautions d’emploi
- La survenue d’effets indésirables peut être minimisée avec la dose efficace minimale pendant la durée d’administration la plus courte possible pour maîtriser les symptômes (voir rubrique 4.2 et ci-dessous, risques gastro intestinaux et cardiovasculaires) ;
- Il est recommandé d’éviter l’administration simultanée de diclofénac et d’autres AINS, y compris les inhibiteurs sélectifs de la cyclo-oxygénase-2 (Coxib). Il n’y a pas d’évidence au sujet des effets synergiques et des potentiels effets indésirables additionnels. ;
- Il faut faire attention aux sujets âgés pour leurs conditions médicales spéciales. Surtout chez les patients âgés fragiles ou avec du poids corporel bas. Dans ces cas l’utilisation de la dose inférieure effective est recommandée ;
- Comme d’autres anti-inflammatoires non stéroïdiens, le diclofénac peut provoquer, dans de rares cas, l’apparition de réactions allergiques, y compris des réactions anaphylactiques ou anaphylactoïdes, même en absence de toute exposition préalable au médicament ;
- Comme avec d’autres anti-inflammatoires non stéroïdiens, en raison de ses propriétés pharmacodynamiques, Dolotren® peut masquer les signes et symptômes d’une infection ;
- Les instructions pour l’administration d’injections intramusculaires doivent se suivre de manière stricte pour éviter des réactions contraires dans le lieu d’injection qui puissent provoquer une faiblesse musculaire, une paralysie musculaire, hypoesthésie et une nécrose dans le lieu d’injection.
Risques gastro-intestinaux
Hémorragies gastro-intestinales, ulcères et perforations : durant le traitement avec des anti inflammatoires non-stéroïdiens (AINS), parmi lesquels le diclofénac, des cas d’hémorragies gastro-intestinales, d’ulcères et des perforations (qui peuvent être mortelles) pouvant survenir à tout moment du traitement ont été rapportés. Ceux-ci pouvant être accompagnés ou pas de symptômes préalables d’alerte et avec ou sans antécédents d’événements gastro-intestinaux graves. Le risque est supérieur chez les patients âgés.
En cas d’hémorragie gastro-intestinale ou d’ulcère chez les patients traités avec le diclofénac, il est conseillé d’arrêter immédiatement le traitement.
Il est recommandé d’administrer avec précaution les AINS chez les patients présentant des antécédents des altérations gastro-intestinales ou des antécédents d’ulcère gastrique ou intestinal, hémorragie ou perforation (voir rubrique 4.8).
Le risque d’hémorragie gastro-intestinale est plus élevé lorsque des doses croissantes d’AINS sont utilisées chez les patients présentant des antécédents d’ulcère, en particulier d’ulcères accompagnés d’une hémorragie ou d’une perforation (voir rubrique 4.3).
Chez les patients âgés, la fréquence des effets indésirables des AINS est plus élevée, surtout dans les cas d’hémorragies gastro-intestinales et perforation, qui peuvent conduire à la mort. Ces patients doivent commencer le traitement avec la dose la plus faible possible. Il est recommandé de prescrire à ces patients un traitement concomitant avec des agents protecteurs (par exemple : misoprostol ou des inhibiteurs de la pompe à protons) ; ce traitement combiné doit également être considéré dans le cas de patients nécessitant une dose faible d’acide acétylsalicylique ou d’autres médicaments susceptibles d’augmenter le risque gastro-intestinal (voir ci-dessous et rubrique 4.5).
Il convient de signaler aux patients présentant des antécédents de toxicité gastro-intestinale, et notamment aux personnes âgées, qu’ils doivent informer immédiatement le médecin de tout symptôme abdominal rare (en particulier les saignements gastro-intestinaux) pendant le traitement, surtout, au début.
La prudence s’impose chez les patients recevant des traitements concomitants susceptibles d’augmenter le risque d’ulcère ou de saignement gastro-intestinal, tels que les corticoïdes systémiques, anticoagulants oraux du type dicoumarinique, et les médicaments antiagrégants plaquettaires du type acide acétylsalicylique et d’antidépresseurs inhibiteurs sélectifs de la recapture de la sérotonine (voir rubrique 4.5).
Il est recommandé d’administrer avec précaution les AINS chez les patients présentant des antécédents de colite ulcéreuse ou de maladie de Crohn car ils pourraient provoquer une exacerbation de cette pathologie (voir rubrique 4.8).
Risques cardiovasculaires et cérébrovasculaires
Une prudence particulière est recommandée chez les patients présentant des antécédents d’hypertension et/ou d’insuffisance cardiaque (stade I de la classification NYHA), l’apparition d’une rétention de liquides et d’un œdème liés au traitement par les AINS ayant été rapportée.
Des données issues d’essais cliniques et les données épidémiologiques indiquent de manière cohérente une augmentation du risque d’évènements thrombotiques artériels (par exemple : infarctus du myocarde ou accident vasculaire cérébral), liée à l’utilisation du diclofénac, notamment à des doses élevées (150 mg par jour) et dans des traitements au long cours.
En conséquence, les patients souffrant d’une insuffisance cardiaque congestive (stade I de la classification NYHA) et ceux présentant des facteurs de risque cardiovasculaire (p. ex. : hypertension, hyperlipidémie, diabète, tabagisme) doivent uniquement être traités par le diclofénac après une évaluation attentive.
Compte tenu de l’éventuelle augmentation des risques cardiovasculaires du diclofénac en fonction de la dose et de la durée du traitement, il convient d’utiliser la dose quotidienne efficace minimale pendant la durée la plus courte possible.
Effets hématologiques
L’administration de ce médicament est uniquement recommandée en traitement de courte durée. Toutefois, comme avec d’autres AINS, en cas d’administration plus prolongée, il est conseillé d’effectuer la numération des globules rouges.
Comme d’autres AINS, le diclofénac peut provoquer une inhibition passagère de l’agrégation plaquettaire. Les patients présentant des anomalies de l’hémostase doivent être étroitement surveillés.
Effets respiratoires (asthme préexistant)
Chez les patients asthmatiques, les patients souffrant d’une rhinite allergique saisonnière, d’une inflammation de la muqueuse nasale (c’est-à-dire de polypes nasaux), d’une maladie pulmonaire obstructive chronique ou d’infections chroniques du tractus respiratoire (en particulier si elles sont liées à des symptômes similaires à ceux de la rhinite allergique), les réactions aux AINS, telles que des exacerbations de l’asthme (également appelées intolérance aux analgésiques/asthme analgésique), un œdème de Quincke (angio-œdème) ou une urticaire, sont plus fréquentes que chez d’autres patients.
Une prudence particulière est donc recommandée chez ces patients (il convient d’être prêt pour une urgence). Cela est également valable pour les patients allergiques à d’autres substances, présentant, par exemple, des réactions cutanées, un prurit ou une urticaire.
Une prudence particulière est recommandée avec l’administration du diclofénac par voie parentérale chez les patients souffrant d’asthme branchial par ce qu’il peut apparaître une exacerbation des symptômes.
Risques de réactions cutanées graves
Des réactions cutanées graves, certaines mortelles, ont été rapportées, notamment la dermatite exfoliative, le syndrome de Stevens-Johnson et la nécrolyse épidermique toxique avec une fréquence très rare (moins d’un patient sur 10 000), liées à l’utilisation d’AINS (voir rubrique 4.8). Il semble que les patients soient plus exposés à ces réactions au début du traitement : dans la majorité des cas, l’apparition de cet effet indésirable se produit au cours du premier mois de traitement.
Il est conseillé d’arrêter immédiatement l’administration de Dolotren® dès les premiers symptômes d’érythème cutané, de lésions muqueuses ou d’autres signes d’hypersensibilité.
Risques de réactions hépatiques
Les patients souffrant d’une insuffisance hépatique traités par le diclofénac doivent être surveillés car leur situation peut s’aggraver.
Les AINS, y compris le diclofénac, peuvent provoquer une élévation du taux des enzymes hépatiques. Par mesure de précaution, il est recommandé de contrôler la fonction hépatique pendant le traitement au long cours avec le diclofénac.
Il est recommandé d’arrêter le traitement si les examens de la fonction hépatique montrent des anomalies qui persistent ou s’aggravent, si des signes et symptômes cliniques de développement d’une maladie hépatique ou d’autres symptômes surviennent (p. ex. : éosinophilie, éruption cutanée). Une hépatite peut survenir sans symptômes prodromiques. Le diclofénac peut déclencher un épisode aigu chez les patients présentant une porphyrie.
Effets rénaux
Compte tenu du fait que des cas de rétention de liquides et d’œdème liés au traitement par les AINS, y compris le diclofénac, ont été rapportés, une prudence particulière est recommandée chez les patients présentant une altération de la fonction cardiaque ou rénale, des antécédents d’hypertension, chez les personnes âgées, les patients recevant un traitement diurétique ou d’autres médicaments susceptibles d’affecter la fonction rénale de manière significative, et chez ceux présentant une déplétion importante du volume extracellulaire, quelle qu’en soit la cause, par exemple, lors de la phase pré ou postopératoire d’interventions chirurgicales majeures (voir rubrique 4.3).
Il est par conséquent recommandé, par mesure de précaution, de contrôler la fonction rénale lors de l’administration du diclofénac dans ces cas. L’arrêt du traitement permet généralement de retrouver l’état antérieur à celui-ci.
Utilisation chez les patients âgés
Les personnes âgées présentent une incidence plus élevée d’effets indésirables aux AINS, en particulier d’hémorragies et de perforations gastrointestinales, qui peuvent être mortelles (voir rubrique 4.2).
En outre, les AINS peuvent provoquer une rétention de liquides, pouvant entraîner des complications cardiovasculaires et une réduction de l’efficacité des traitements antihypertenseurs. Il est recommandé d’utiliser la dose la plus faible efficace.
4.5 Interactions avec d’autres médicaments et autres formes d’interactions
(Y compris celles observées avec d’autres formes d’administration du diclofénac)
- + Lithium : en cas d’utilisation simultanée, le diclofénac peut augmenter la concentration plasmatique de lithium. Un contrôle des taux sériques de lithium est recommandé ;
- + Digoxine : en cas d’utilisation simultanée, le diclofénac peut augmenter la concentration plasmatique de digoxine. Un contrôle des taux sériques de digoxine est recommandé ;
- + Antagonistes du calcium (isradipine, vérapamil) : des études ont montré une réduction de leur efficacité thérapeutique, due à l’action du diclofénac ;
- + Médicaments antihypertenseurs : comme avec d’autres AINS, l’utilisation simultanée de diclofénac et de diurétiques ou de médicaments antihypertenseurs (p. ex. : bêtabloquants, inhibiteurs de l’enzyme de conversion de l’angiotensine [IECA]) peut réduire leur action antihypertensive en raison de l’inhibition de la synthèse des prostaglandines.
Par conséquent, le traitement doit être administré avec prudence et les patients, en particulier les patients âgés, doivent contrôler régulièrement leur pression artérielle. Une hydratation correcte des patients et une surveillance de la fonction rénale sont recommandées après l’instauration du traitement concomitant, puis régulièrement par la suite, surtout avec les diurétiques et les IECA, en raison de l’augmentation du risque de néphrotoxicité (voir rubrique 4.4) ; - + Médicaments pouvant provoquer une hyperkaliémie : le traitement concomitant par des médicaments épargneurs de potassium, la cyclosporine, le tacrolimus ou le triméthoprime peut être associé à une augmentation des taux de potassium. Par conséquent, une surveillance régulière s’impose (voir rubrique 4.4) ;
- + Autres AINS et corticostéroïdes :l’administration simultanée de diclofénac et d’autres AINS ou de corticostéroïdes peut augmenter l’apparition d’effets indésirables gastro-intestinaux (voir rubrique 4.4) ;
- + Anticoagulants et antiagrégants plaquettaires : la prudence est de rigueur car l’administration simultanée pourrait augmenter le risque d’hémorragie (voir rubrique 4.4). Bien que les recherches cliniques ne semblent pas indiquer que le diclofénac affecte l’action des anticoagulants, des rapports révèlent un risque accru d’hémorragie chez les patients recevant simultanément le diclofénac et des anticoagulants. Une surveillance étroite est donc recommandée chez ces patients ;
- + Les inhibiteurs sélectifs de la recapture de la sérotonine {ISRS} : ces derniers peuvent également augmenter le risque de saignements gastro-intestinaux (voir rubrique 4.4) ;
- + Antidiabétiques : les essais cliniques ont démontré que le diclofénac peut être administré conjointement à des antidiabétiques oraux sans altérer leur effet clinique. Cependant, des cas isolés d’effets hypoglycémiants et hyperglycémiants avec le diclofénac ont été rapportés, rendant nécessaire la modification de la dose des antidiabétiques.
Pour cette raison, il est recommandé, par mesure de précaution, de contrôler les taux sanguins de glucose pendant le traitement simultané ; - + Méthotrexate : le diclofénac inhibe la clairance rénale tubulaire du méthotrexate. Il augmente donc les taux de méthotrexate. La prudence est recommandée en cas d’administration d’AINS, y compris le diclofénac, moins de 24 heures avant ou après un traitement par le méthotrexate car la concentration plasmatique de méthotrexate peut augmenter et majorer par conséquent la toxicité de ce dernier ;
- + Ciclosporine : le diclofénac, comme d’autres AINS, peut augmenter la néphrotoxicité de la cyclosporine, en raison des effets sur les prostaglandines rénales. Par conséquent, le diclofénac doit être administré à des doses plus faibles que celles que l’on utiliserait chez les patients ne prenant pas de cyclosporine ;
- + Quinolones antibactériennes : des cas isolés de convulsions ont été rapportés, probablement dues à l’utilisation simultanée de quinolones et d’AINS ;
- + Ceftriaxone : des études ont montré une augmentation de son élimination due à l’action du diclofénac ;
- + Inhibiteurs puissants du CYP2C9 : la prudence est de mise lorsque le diclofénac est administré avec des inhibiteurs puissants du CYP2C9, tels que la sulfinpyrazone et le voriconazole, qui augmentent significativement les concentrations plasmatiques de diclofénac en raison de l’inhibition du métabolisme du diclofénac ;
- + Phénytoïne : en cas d’utilisation simultanée de la phénytoïne et du diclofénac, il est recommandé de surveiller les taux plasmatiques de phénytoïne car il faut s’attendre à une augmentation de l’exposition à la phénytoïne ;
- + Alcool : une potentialisation de la toxicité des anti-inflammatoires non-stéroïdiens peut être observée ;
- + Misoprostol : une potentialisation de la toxicité du misoprostol peut être observée en cas d’administration simultanée avec des anti-inflammatoires non-stéroïdiens ;
- + Pentazocine : des études ont montré l’apparition de crises convulsives de type tonico clonique lors de l’administration simultanée d’anti-inflammatoires non-stéroïdiens ;
- + Résines échangeuses d’ions (cholestyramine, colestipol) : des études ont révélé une réduction de l’efficacité thérapeutique du diclofénac, due à une réduction de son absorption.
4.6 Fertilité, grossesse et allaitement
Fertilité
Comme avec d’autres anti-inflammatoires non-stéroïdiens, l’utilisation du diclofénac peut affecter la fertilité féminine et n’est pas recommandée chez les femmes désirant une grossesse. Chez les femmes ayant des difficultés à concevoir ou à la recherche des causes de leur infertilité, l’arrêt de ce médicament doit être envisagé.
Grossesse
Premier et deuxième trimestre de la grossesse
L’inhibition de la synthèse des prostaglandines peut affecter négativement la grossesse et/ou le développement de l’embryon ou du fœtus. Des données issues d’études épidémiologiques suggèrent une augmentation du risque d’avortement, de malformations cardiaques et d’un gastroschisis après l’utilisation d’un inhibiteur de la synthèse des prostaglandines à un stade précoce de la grossesse. Le risque absolu de malformations cardiaques a augmenté de moins de 1% à environ 1,5%. Il semble que le risque augmente avec la dose et la durée du traitement. Au cours du premier et du deuxième trimestre de la grossesse, l’administration du diclofénac est déconseillée, sauf si le médecin juge que cela est strictement nécessaire. Si le diclofénac est utilisé par une femme désirant une grossesse ou au cours du premier et du deuxième trimestre de la grossesse, la dose doit être la plus faible possible et le traitement, le plus court possible.
Troisième trimestre de la grossesse
Au cours du troisième trimestre de la grossesse, tous les inhibiteurs de la synthèse des prostaglandines peuvent exposer le fœtus aux effets suivants :
- Toxicité cardio-pulmonaire (avec fermeture prématurée du ductus arteriosus et hypertension pulmonaire) ;
- Dysfonctionnement rénal pouvant évoluer jusqu’à l’insuffisance rénale avec un oligoamnios ;
- Allongement éventuel du temps d’hémorragie dû à un effet de type antiagrégant susceptible de survenir même à des doses très faibles ;
- Inhibition des contractions utérines, susceptible de retarder l’accouchement ou d’allonger sa durée.
Par conséquent, le diclofénac est contre-indiqué au cours du troisième trimestre de la grossesse (voir rubrique 4.3).
Allaitement
Comme d’autres anti-inflammatoires non-stéroïdiens, le diclofénac passe en petites quantités dans le lait maternel. Par conséquent, le diclofénac ne doit pas être administré pendant l’allaitement afin d’éviter la survenue d’effets indésirables chez le nourrisson.
4.7 Effet sur l’aptitude à la conduite et l’utilisation de machines
L’influence du diclofénac sur l’aptitude à conduire de véhicules et à utiliser des machines est nulle ou négligeable. Cependant, les patients présentant des troubles visuels, des étourdissements, des vertiges, une somnolence ou d’autres troubles du système nerveux central pendant la prise du traitement par ce médicament doivent s’abstenir de conduire des véhicules ou d’utiliser des machines.
4.8 Effets indésirables
Les effets indésirables les plus fréquemment observés sont de nature gastro-intestinale. On peut observer des ulcères peptiques, une perforation ou une hémorragie gastro-intestinale, dans certains cas mortelle, en particulier chez les personnes âgées (voir rubrique 4.4).
Les effets suivants ont également été rapportés : nausées, vomissements, diarrhée, flatulence, constipation, dyspepsie, douleur abdominale, méléna, hématémèse, stomatite ulcéreuse, exacerbation de la colite ulcéreuse et maladie de Crohn (voir rubrique 4.4). L’apparition d’une gastrite a été moins fréquemment observée.
Les effets indésirables suivants incluent les effets rapportés lors de traitements de courte ou Les effets indésirables (rapportés dans des essais cliniques et/ou des notifications spontanées ou des références bibliographiques) sont classés par organes et systèmes selon le MedDRA, par ordre de fréquences, les plus fréquents apparaissant en premier.
Au sein de chaque groupe de fréquence, les effets indésirables sont énumérés par ordre décroissant de gravité. En outre, chaque groupe de fréquence utilise la convention suivante (CIOMS Ill) pour chaque effet indésirable : très fréquent (≥ 1/10), fréquent (≥ 1/100 à < 1/10), peu fréquent (≥ 1/1 000 à < 1/100), rare (≥ 1/10 000 à < 1/1 000), très rare (< 1/10 000), fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
Les effets indésirables suivants incluent les effets rapportés lors de traitements de courte ou de longue durée par Dolotren® 75 mg solution injectable ou d’autres formes pharmaceutiques du diclofénac.
Infections et infestations
- Très rare : abcès au site d’injection ;
- Fréquence indéterminée : nécrose au point d’injection.
Affections hématologiques et du système lymphatique
Très rare : thrombocytopénie, leucopénie, anémie (y compris anémie hémolytique et anémie aplasique), agranulocytose.
Affections du système immunitaire
- Rare : hypersensibilité anaphylactique et réactions systémiques anaphylactoïdes, incluant l’hypotension et le choc ;
- Très rare : œdème angioneurotique (incluant l’œdème facial).
Affections psychiatriques
Très rare : désorientation, dépression, insomnie, cauchemars, irritabilité, troubles psychotiques.
Affections du système nerveux
- Fréquent : céphalées, étourdissements ;
- Rare : somnolence ;
- Très rare : paresthésies, troubles de la mémoire, convulsions, anxiété, tremblement, méningite aseptique, altérations du goût, accident vasculaire cérébral.
Affections oculaires
Très rare : troubles visuels, vision trouble, diplopie.
Affections de l’oreille et du labyrinthe
- Fréquent : vertige ;
- Très rare : acouphènes, troubles de l’ouïe.
Affections cardiaques
Très rare : palpitations, douleur thoracique, insuffisance cardiaque, infarctus du myocarde.
Affections vasculaires
Très rare : hypertension, vascularite.
Affections respiratoires, thoraciques et médiastinales
- Rare : asthme (incluant la dyspnée) ;
- Très rare : pneumopathie.
Affections gastro-intestinales
- Fréquent : nausées, vomissements, diarrhée, douleur abdominale, dyspepsie, flatulence, anorexie ;
- Rare : gastrite, hémorragie gastro-intestinale, hématémèse, méléna, diarrhée hémorragique, ulcère gastrique ou intestinal (avec ou sans hémorragie ou perforation) ;
- Très rare : colite (y compris la colite hémorragique et l’exacerbation de la colite ulcéreuse ou la maladie de Crohn), stomatite, glossite, troubles de l’œsophage, sténoses intestinales de type diaphragmatique, constipation, pancréatite, aphtes dans la bouche ;
- Fréquence indéterminée : colite ischémique.
Affections hépatobiliaires
- Fréquent : augmentation du taux des transaminases sériques ;
- Rare : hépatite avec ou sans ictère, trouble hépatique ;
- Cas isolé s: hépatite fulminante, nécrose hépatique, insuffisance hépatique.
Affections de la peau et du tissu sous-cutané
- Fréquent : éruptions cutanées ;
- Rare : urticaire ;
- Très rare : réactions bulleuses, notamment le syndrome de Stevens-Johnson et la nécrolyse épidermique toxique (syndrome de Lyell), eczéma, érythème, érythème polymorphe, dermatite exfoliative, chute de cheveux, réaction de photosensibilité, purpura, purpura allergique, prurit.
Affections du rein et des voies urinaires
Très rare : insuffisance rénale aiguë, hématurie, protéinurie, néphrite interstitielle, syndrome néphrotique, nécrose papillaire rénale.
Troubles généraux et anomalies au site d’administration
- Fréquent : réaction au point d’injection, douleur au point d’injection, induration au point d’injection ;
- Rare : œdème et nécrose au point d’injection.
Des données issues d’essais cliniques et les données épidémiologiques indiquent de manière cohérente une augmentation du risque d’évènements thrombotiques artériels (par exemple : infarctus du myocarde ou accident vasculaire cérébral), liée à l’utilisation du diclofénac, notamment à des doses élevées (150 mg par jour) et dans des traitements au long cours (voir rubriques 4.3 et 4.4).
Déclaration des effets indésirables suspectés : La déclaration des effets indésirables suspectés après autorisation du médicament est importante. Elle permet une surveillance continue du rapport bénéfice/risque du médicament.
4.9 Surdosage
Symptômes
Aucun tableau clinique caractéristique d’un surdosage par le diclofénac n’a été rapporté.
En cas de surdosage, les symptômes suivants peuvent être observés : vomissements, hémorragie gastro-intestinale, diarrhée, étourdissement, acouphènes ou convulsions. Un surdosage important peut entraîner la survenue d’une insuffisance rénale aiguë et de lésions hépatiques.
Traitement
En cas de surdosage par les AINS, y compris le diclofénac, les mesures thérapeutiques consistent à prendre des mesures de soutien et à instaurer un traitement symptomatique. Ces mesures doivent être appliquées en cas de complications telles que l’hypotension, l’insuffisance rénale, les convulsions, les troubles gastro-intestinaux et la dépression respiratoire.
Les mesures spécifiques (diurèse forcée, dialyse ou hémoperfusion) sont probablement peu efficaces pour éliminer les AINS, y compris le diclofénac, en raison de leur taux élevé de liaison protéique et de leur métabolisme important.
5 – PROPRIÉTÉS PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : anti-inflammatoires et antirhumatismaux non-stéroïdiens Dérivés de l’acide acétique et substances apparentées. Code ATC : M01AB05.
Mécanisme d’action
Le diclofénac de sodium est un composé non stéroïdien possédant des propriétés antiinflammatoires, antalgiques et antipyrétiques. On considère que son mécanisme d’action est essentiellement lié à l’inhibition, expérimentalement prouvée, de la biosynthèse des prostaglandines. Les prostaglandines jouent un rôle majeur dans l’apparition de l’inflammation, de la douleur et de la fièvre.
A des concentrations équivalentes à celles que l’on atteint chez l’homme, le diclofénac de sodium n’inhibe pas in vitro la biosynthèse des protéoglycanes dans le cartilage.
Effets pharmacodynamiques
Dans les affections rhumatismales, les propriétés anti-inflammatoires et antalgiques du diclofénac déclenchent une réponse clinique caractérisée par une nette amélioration des signes et symptômes (douleur au repos et au mouvement, raideur matinale, tuméfaction des articulations), ainsi que par une amélioration de la capacité fonctionnelle.
Il a été prouvé l’effet analgésique du diclofénac dans des conditions de douleur non rhumatismales modérés et graves, effet qui est établi dans les 15-30 minutes suivant l’administration.
Dans les inflammations post-traumatiques, le diclofénac soulage et réduit la tuméfaction inflammatoire et l’œdème traumatique.
Lorsqu’il est utilisé en association avec des opioïdes dans le traitement de la douleur postopératoire, Dolotren® 75 mg solution injectable réduit significativement la dose requise d’opioïdes.
Dolotren® 75 mg solution injectable est particulièrement appropriée comme traitement initial dans les maladies rhumatismales inflammatoires et dégénératives et dans des conditions douloureuses dues à une inflammation d’origine non rhumatismale.
5.2. Propriétés pharmacocinétiques
Absorption
Après l’injection intramusculaire de 75 mg de diclofénac l’absorption est immédiate et les concentrations plasmatiques maximales moyennes de 2,5 microg/ml (8 micromoles/L) sont atteintes en 20 minutes.
Les concentrations plasmatiques baissent rapidement après avoir atteint un pic après une injection intramusculaire ou de l’administration des comprimés entériques ou de suppositoires. L’aire sous la courbe de concentration plasmatique est approximativement le double de celle obtenue après administration de la même dose par voie orale ou rectale, en raison d’environ la moitié de la dose absorbée est métabolisé par l’effet de premier passage hépatique lorsqu’il est administré via une des deux voies d’administration. Le profil pharmacocinétique est resté inchangé après l’administration répétée. Aucune accumulation se produit à condition que les intervalles de dose recommandée soient respectés.
Distribution
Le diclofénac est lié à 99,7% aux protéines sériques, essentiellement à l’albumine (99,4%). Le volume de distribution apparent calculé est de 0,12-0,17 L/kg. Le diclofénac passe dans le liquide synovial où les concentrations maximales sont obtenues 2 à 4 heures après que les valeurs plasmatiques maximales aient été atteintes. La demi-vie apparente d’élimination du liquide synovial est de 3 à 6 heures. Deux heures après avoir atteint les concentrations plasmatiques maximales, les concentrations de substance active sont plus élevées dans le liquide synovial que dans le plasma et le restent pendant 12 heures.
Dans la femme qui allaite, de faibles concentrations de diclofénac ont été détectées dans le lait maternel (100 ng/ml). On estime que l’enfant aurait ingéré après avoir sucé un montant équivalent à la dose de 0,03 mg/kg/jour (voir rubrique 4.6).
Biotransformation
La biotransformation du diclofénac s’effectue en partie par glucuroconjugaison de la molécule inchangée, mais surtout par hydroxylation simple et multiple et par méthoxylation, entraînant la formation de plusieurs métabolites phénoliques (3′-hydroxy-, 4′-hydroxy-, 5-hydroxy-, 4’5- dihydroxy- et 3′-hydroxy-4′-méthoxydiclofénac), qui sont transformés pour la plupart en métabolites glucuroconjugués. Deux de ces métabolites phénoliques sont biologiquement actifs, mais à un degré nettement moindre que le diclofénac.
Elimination
Après administration par voie systémique, la clairance plasmatique du diclofénac est de 263 ± 56 ml/min.
La demi-vie plasmatique terminale est de 1 à 2 heures. Quatre des métabolites, dont les deux actifs, ont également une demi-vie plasmatique brève de 1 à 3 heures. Un des métabolites, le 3′-hydroxy-4′-méthoxydiclofénac, a une demi-vie plasmatique beaucoup plus longue. Cependant, ce métabolite est pratiquement inactif.
Environ 60% de la dose administrée sont excrétés dans l’urine sous forme d’un glucuroconjugué de la molécule inchangée et sous forme de métabolites également glucuroconjugués pour la plupart. Moins de 1% est excrété sous forme inchangée.
Le reste de la dose est éliminé sous forme de métabolites par la bile ou dans les fèces.
Linéarité
La quantité absorbée est linéairement proportionnelle à la dose administrée.
Populations particulières
Aucune relation significative entre l’âge du patient et l’absorption, le métabolisme et l’excrétion n’a été observée.
Chez les patients présentant des troubles rénaux, la cinétique de dose unique administrée selon le schéma posologique habituel ne montre aucune accumulation de substance active inchangée. Avec une clairance de la créatinine inférieure à 10 ml/min, les concentrations plasmatiques calculées à l’état d’équilibre sont environ quatre fois plus élevées que celles observées chez les sujets sains. Cependant, les métabolites sont finalement excrétés par voie biliaire.
Chez les patients présentant une hépatite chronique ou une cirrhose non décompensée, la cinétique du diclofénac n’est pas affectée.
5.3. Données de sécurité précliniques
Les données précliniques issues d’études de toxicité aiguë et de toxicité après administration répétée, ainsi que des études de génotoxicité et de cancérogénèse semblent indiquer que le diclofénac ne présente pas de risque particulier pour l’homme aux doses thérapeutiques utilisées. Chez la souris, le rat ou le lapin, lors des études précliniques habituelles, aucun potentiel tératogène du diclofénac n’a été mis en évidence. Cependant, le diclofénac peut avoir un effet négatif sur la grossesse et/ou le développement de l’embryon/du fœtus chez la femme (voir rubrique 4.6 grossesse).
Chez le rat, le diclofénac n’a pas d’effets sur la fertilité des parents, à l’exception d’un effet minime sur le fœtus à des doses maternelles toxiques. Aucun trouble du développement prénatal, périnatal et postnatal de la descendance n’a été observé. Cependant, le diclofénac peut affecter la fertilité chez la femme (voir rubrique 4.6 fertilité).
L’administration d’AINS, y compris le diclofénac, inhibe l’ovulation chez la lapine, l’implantation et la placentation chez la rate et provoque une fermeture prématurée du canal artériel chez les rates gestantes. Chez la rate, l’administration de diclofénac à des doses maternelles toxiques a été associée à une dystocie, à un allongement de la gestation, à une diminution de la survie des fœtus et à un retard de croissance intra-utérin. Les effets minimes du diclofénac sur la reproduction et la mise bas ainsi que sur la constriction du canal artériel in utero sont des conséquences pharmacologiques de cette classe d’inhibiteurs de la synthèse des prostaglandines (voir rubrique 4.3 et 4.6).
6 – DONNEES PHARMACEUTIQUES
6.1. Liste des excipients
Propylène glycol, Alcool benzylique, Mannitol (E421), Métabisulfite de sodium (E-223), Hydroxyde de sodium, Eau pour préparations injectables.
6.2. Incompatibilités
La solution injectable Dolotren® 75 mg ne doit pas être mélangée avec d’autres solutions injectables.
6.3. Durée de conservation
5 ans à partir de la date de fabrication.
6.4. Précautions particulières de conservation
Conserver à une température inférieure à 30°C.
6.5. Nature et contenu de l’emballage extérieur
Dolotren® 75 mg solution injectable se présente dans un récipient avec 6 ampoules de 3 ml incolores contenant une solution aqueuse limpide, incolore ou légèrement jaune, exempt de particules étrangères.
Dolotren® 75 mg solution injectable est également disponible dans des emballages contenant 100 ampoules (emballage clinique).
6.6. Précautions particulières d’élimination et de manipulation
Tout produit non-utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7 – CONDITIONS DE PRESCRIPTION ET DE DELIVRANCE
Liste II.
8 – TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
FAES FARMA, S.A.
Maxima Aguirre, 14 48940 Leioa
ESPAGNE
9. DATE DE RÉVISION DU TEXTE
Mai 2014.
Dernière mise à jour de cette page
24/02/2020.