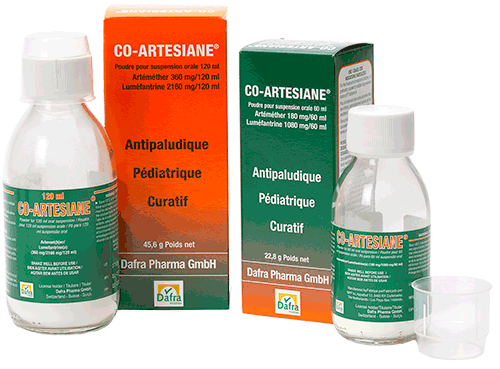
Co-Artesiane®
1. Dénomination du médicament
Co-Artesiane® (Artéméther –Luméfantrine).
Poudre pour suspension orale.
2. Composition qualitative et quantitative
Artémether 3 mg/ml –Luméfantrine 18 mg/ml.
Co-Artesiane® 60 ml
Flacon avec 22,8 g de poudre contenant 180 mg d’artéméther et 1080 mg de luméfantrine.
Co-Artesiane® 120 ml
Flacon avec 45,6 g de poudre contenant 360 mg d’artéméther et 2160 mg de luméfantrine.
Excipients à effet notoire :
- Parahydroxybenzoate de méthyle : 0.8 mg/ml ;
- Parahydroxybenzoate de propyle : 0.2 mg/ml ;
- Saccharose : 328 mg/ml.
Pour la liste complète des excipients, voir rubrique 6.1.
Les deux présentations peuvent ne pas être commercialisées dans chaque pays.
3. Forme pharmaceutique et présentation
Poudre pour suspension buvable.
Poudre jaune.
La suspension reconstituée a une couleur jaune et un goût de noix de coco.
Présentations
Chaque boîte en carton contient 1 flacon en verre contenant de l’artéméther (Β-artéméther) et de la luméfantrine dans un mélange de poudre sèche pour la préparation d’une suspension à usage oral après addition d’eau, une notice avec les instructions d’usage ainsi qu’une mesure graduée, subdivisée en unités de 1 ml et de 5 ml.
- Co-Artesiane® 60 ml : poudre pour la préparation de 60 ml de suspension buvable ;
- Co-Artesiane® 120 ml : poudre pour la préparation de 120 ml de suspension buvable.
Après addition d’eau jusqu’au repère et agitation vigoureuse du mélange, une suspension jaune au parfum agréable de noix de coco se forme.
4. Données cliniques
4.1 Indications thérapeutiques
Co-Artesiane® est recommandée chez les enfants dans le traitement du paludisme causé par toutes les formes de Plasmodium, y compris les souches pharmaco résistantes de P. falciparum. En cas d’infection par P. vivax, un traitement supplémentaire par primaquine peut s’avérer nécessaire.
4.2. Posologie et mode d’administration
Posologie
Co-Artesiane® suspension a été conçue spécialement pour les enfants. Le dosage dépend de la sévérité du cas et de l’état clinique du patient : en général 4 mg d’artéméther/kg de poids corporel en association avec de la luméfantrine par jour.
Cette dose sera prise pendant trois jours consécutifs.
La dose journalière est administrée en une seule prise.
Pour éviter les rechutes, il est nécessaire d’achever le traitement total de trois jours. En cas de vomissements dans les 30 minutes suivant la prise de la suspension, la dose totale doit être réadministrée. En cas de vomissements dans l’heure suivant la prise, une demi-dose doit être réadministrée.
Préparation de la suspension de Co-Artesiane®
Après ouverture du flacon (en brisant le sceau), ajouter de l’eau d’une bonne qualité jusqu’au repère indiquant 60 ml. À l’adjonction d’eau, le mélange prend la couleur jaune. Après adjonction de l’eau, secouer vigoureusement le flacon pour s’assurer de la mise en suspension de toute la quantité de poudre présente. La composition de la poudre est telle que ce procédé ne demande que quelques secondes.
Rectifier, au besoin, le niveau en ajoutant de l’eau jusqu’au repère de 60 ml.
Cette suspension reconstituée reste stable et peut être utilisée jusqu’à 28 jours après préparation. Il est à conseiller d’agiter la bouteille chaque fois avant l’usage. Le verre transparent est choisi facilitant le contrôle de la mise en suspension.
Schéma posologique
Pour chaque patient (en fonction de son poids), il sera nécessaire de calculer la dose en millilitres à administrer.
Chaque sous-unité de 5 ml contient 15 mg d’artéméther et 90 mg de luméfantrine.
Un (1) ml de la suspension reconstituée contient 3 mg d’artéméther et 18 mg de luméfantrine.
La dose journalière est calculée sur 4 mg d’artéméther par kg de poids corporel du patient. Arrondir la dose à la subdivision la plus proche.
| Présentation | Poids (kg) | Dose journalière (ml) | ||
|---|---|---|---|---|
| Jour 1 | Jour 2 | Jour 3 | ||
| Flacon de Co-Artesiane® 60 ml | 5 | 7 | 7 | 7 |
| 6 | 8 | 8 | 8 | |
| 7-8 | 10 | 10 | 10 | |
| 9-10 | 13 | 13 | 13 | |
| 11-12 | 15 | 15 | 15 | |
| 13-14 | 18 | 18 | 18 | |
| Flacon de Co-Artesiane® 120 ml | 15-17 | 22 | 22 | 22 |
| 18-20 | 25 | 25 | 25 | |
| 21-23 | 29 | 29 | 29 | |
| 24-26 | 33 | 33 | 33 | |
| 27-29 | 37 | 37 | 37 | |
| 30 | 40 | 40 | 40 | |
Un traitement supplémentaire par Co-Artesiane® peut s’avérer nécessaire si le paludisme se manifeste à nouveau (rechute) ou en cas de nouvelle infection par une souche différente de Plasmodium après la guérison.
Mode d’administration
Par voie orale.
La prise alimentaire favorise l’absorption de l’artéméther et de la luméfantrine. Pour favoriser l’absorption une prise alimentaire avec des avec des aliments ou des boissons riches en graisses comme le lait est recommandée.
Populations spécifiques
Insuffisants rénaux, insuffisants hépatiques
L’association d’Atéméther et Luméfantrine n’a pas été étudiée chez des patients souffrant d’une insuffisance rénale ou un insuffisance hépatique.
Population pédiatrique
La forme Co-Artesiane® a été développée pour le traitement chez l’enfant.
4.3. Contre-indications
Co-Artesiane® est contre-indiqué dans les cas suivants :
- Hypersensibilité aux substances actives ou à l’un des excipients mentionnés à la rubrique 6.1. ;
- Traitement concomitant par un médicament métabolisé par le cytochrome CYP2D6 (tell que le métopropol, l’imipramine, l’amitriptyline, la clomipramine) ;
- Antécédents familiaux de mort subite ou antécédents de QTc long congénital, ou tout autre facteur de risque d’augmentation de l’intervalle QTc ;
- Traitement concomitant par d’autres médicaments susceptibles de favoriser l’allongement de l’intervalle QTc (pro arythmiques) tels que :
- antiarythmiques de classe IA et III ;
- neuroleptiques , antidépresseurs ;
- certains antibiotiques et agents des classes suivantes : macrolides, fluoroquinolones, imidazolés, antifongiques triazolés ;
- certains antihistaminiques non sédatifs (terfénadine, astémizole) ;
- Cisapride et Flécaïnide.
- Antécédents de troubles du rythme cardiaque symptomatiques, de bradycardie cliniquement significative ou insuffisance cardiaque congestive avec diminution de la fraction d’éjection systolique du ventricule gauche ;
- Anomalies du ionogramme sanguin tels que hypokaliémie ou hypomagnésémie ;
- Traitement concomitant par de puissants inducteurs du CYP3A4 tels que la rifampicine, la carbamazépine, la phénytoïne et le millepertuis ( Hypericum perforatum).
4.4 Mise en garde et précautions particulières d’emploi
- L’association d’artéméther et luméfantrine ne doit pas être utilisé pendant le premier trimestre de la grossesse ;
- Les données de tolérance et d’efficacité étant limitées, il convient de ne pas administrer Co-Artesiane® en association à une autre médicament antipaludique, sauf si la situation ne permet pas d’envisager une thérapeutique alternative ;
- Si l’état du patient se dégrade sous Co-Artesiane®, une autre traitement antipaludique doit être instauré sans délai.
Dans ce cas, une surveillance électrocardiographique est recommandée et des mesures devront être prises pour corriger d’éventuels troubles électrolytiques ; - La demi-vie d’élimination de la luméfantrine doit être prise en considération lors de l’administration de quinine à des patients traités préalablement par Co-Artesiane® ;
- Au cas la quinine est administré après Co-Artesiane®, une surveillance étroite de l’ECG est recommandée, en raison du potentiel d’allongement de l’intervalle QT additif/synergique ;
- Si Co-Artesiane® est administré après la prise de méfloquine, une surveillance étroite des apports alimentaires est recommandée ;
- Chez des patients traités préalablement par l’halofantrine, il est recommandé de respecter un délai d’au moins un mois après la dernière prise d’halofantrine avant l’administration de Co-Artesiane® ;
- Co-Artesiane® n’est pas indiqué et n’a pas été évalué pour la prophylaxie du paludisme ;
- Co-Artesiane® doit être utilisé avec précaution chez les patients traités par les médicaments antirétroviraux ( ARV) car la diminution des concentrations d’artéméther, de dihydroartémisinine ( DHA) et/ou de luméfantrine peut aboutir à une diminution de l’efficacité antipaludique du médicament ;
- La prudence est recommandée en cas d’association de Co-Artesiane® avec des médicaments présentant un effet inhibiteur, inducteur modéré ou compétitif sur le CYP3A4 en raison de possibilité d’une modification de l’effet thérapeutique des médicaments associes.
Les médicaments ayant un effet combiné inhibiteur/inducteur sur le CYP3A4, en particulier les médicaments antirétroviraux tels que les inhibiteurs de la protéase du VIH et les inhibiteurs non nucléosidiques de la transcriptase inverse doivent être utilisés avec précaution chez les patients traités par Co-Artesiane® ; - La prudence est recommandée lors de la prise concomitante de Co-Artesiane® avec les contraceptifs hormonaux. La combinaison d’ artéméther-luméfantine peut diminuer l’efficacité des contraceptifs hormonaux.
Par conséquent, il doit être conseillé aux patients prenant des contraceptifs hormonaux par voie orale, dispositif transdermique ou tout autre contraceptif hormonal systématique, d’utiliser une méthode contraceptive supplémentaire non-hormonale pendant environ un mois ; - Chez les patients présentant une intolérance alimentaire qui persiste pendant le traitement, une surveillance étroite est recommandée en raison d’un risque plus élevé d’échec de traitement ;
- Insuffisance rénale : une étude spécifique au sein de cette population n’a pas été mené. La luméfantrine, l’artéméther et la dihydroartémisinine ne sont pas excrétés de façon significative par voie rénale dans des études conduites chez des volontaires aines et l’expérience clinique est limitée. Aucune ajustement posologique n’est recommandée chez les insuffisants rénaux.
La prudence est recommandée chez des patients présentant une insuffisance rénale sévère. Une surveillance ECG et une surveillance de la kaliémie sont recommandées ; - Insuffisance hépatique : une étude spécifique au sein de cette population n’a pas été menée. Chez des patients souffrant d’une insuffisance hépatique sévère, une augmentation cliniquement significative de l’exposition à l’artéméther et à la luméfantrine et/ou à leurs métabolites ne peut être exclue.
Par conséquence, la prudence est requise pour le choix de dose chez des patients hépatiques sévère. Une surveillance ECG et une surveillance de la kaliémie sont recommandées.
Aucune ajustement posologique n’est recommandée chez les patients présentant une insuffisance hépatique légère à modérée ; - Réinfestations : chez un nombre limité de patients résidant en zone d’endémie, une second cure d’artéméther-luméfantrine s’est montrée efficace en traitement d’un nouvel accès par réinfestation.
Néanmoins en l’absence de données de cancérogenèse et de recul clinique suffisant, l’administration de plus de 2 cures consécutives ne peut être recommandée ; - Population pédiatrique : les enfants qui restent opposés à la nourriture pendant le traitement doivent être étroitement surveillés, car le risque de recrudescence peut être plus élevé ;
- Un millilitre (ml) de la suspension Co-Artesiane® contient 0.8 mg de parahydroxybenzoate de méthyle et 0.2 mg de parahydroxybenzoate de propyle.
Ces substances peuvent provoquer des réactions allergiques (éventuellement retardées) ; - Un millilitre (ml) de la suspension Co-Artesiane® contient 328 de saccharose.
Les patients présentant une intolérance au fructose, un syndrome de malabsorption du glucose et du galactose ou un déficit en sucrase/isomaltase (maladies héréditaires rares) ne doivent pas prendre ce médicament.
4.5. Interactions avec d’autres médicaments et autres formes d’interactions
Associations contre-indiquées
Interactions avec des médicaments connus pour allonger l’intervalle QTc
Co-Artesiane® est contre-indiqué avec l’administration concomitante de médicaments (ils peuvent causer des allongements de l’intervalle QTc et des torsades de pointes) tels que : les antiarythmiques de classe IA et III, les neuroleptiques et les antidépresseurs, certains antibiotiques appartenant aux classes suivantes : macrolides, fluoroquinolones, imidazolés, et agents antifongiques triazolés, certains antihistaminiques non sédatifs (terfénadine, astémizole), cisapride, flécaïnide.
Interactions avec des médicaments métabolisés par le CYP2D6
Une inhibition du cytochrome CYP2D6 par la luméfantrine a été observée au cours des études menées in vitro. Cette observation peut être prédictive d’un éventuel retentissement clinique lors de l’administration de produits ayant une marge thérapeutique étroite. L’administration concomitante de la combinaison artéméther-luméfantrine avec des médicaments métabolisés par cette isoenzyme (par exemple les neuroleptiques, le métoprolol, et les antidépresseurs tricycliques tels que l’imipramine, l’amitriptyline et la clomipramine) est ainsi contre-indiquée.
Interactions avec de puissants inducteurs du CYP3A4 tels que la rifampicine
L’administration par voie orale de rifampicine (dose de 600 mg par jour), un puissant inducteur du CYP3A4, avec la combinaison artéméther-luméfantrine chez six patients adultes co-infectés par le VIH-1 et la tuberculose sans être atteints par le paludisme a entrainé une diminution significative de l’exposition à l’artéméther (89%), à la DHA (85%) et à la luméfantrine (68%) par comparaison aux valeurs d’exposition après la prise de la combinaison artéméther-luméfantrine seul. L’utilisation concomitante de puissants inducteurs du CYP3A4 tels que la rifampicine, la carbamazépine, la phénytoïne, le millepertuis est contre-indiquée avec la prise de Co-Artesiane®.
Les médicaments inducteurs ne doivent pas être administrés pendant au moins un mois après la prise de Co-Artesiane®, à moins que le prescripteur ne juge que le traitement soit indispensable.
Associations déconseillées
Interactions avec d’autres médicaments antipaludiques
Les données de sécurité d’emploi et d’efficacité étant limitées, Co-Artesiane® ne doit pas être administré en association à un autre médicament antipaludique, sauf si la situation ne permet pas d’envisager une thérapeutique alternative.
Si Co-Artesiane® est administré après une administration de méfloquine ou de quinine, une étroite surveillance des apports alimentaires (pour la méfloquine) ou de l’ECG (pour la quinine) est recommandée. Il convient de prendre en considération la demi-vie d’élimination longue de la luméfantrine lors de l’administration de quinine chez les patients traités préalablement par Co-Artesiane®.
Chez les patients traités préalablement par l’halofantrine, un délai d’au moins un mois après la dernière prise d’halofantrine doit être respecté avant l’administration de Co-Artesiane®.
Méfloquine
Une étude d’interaction médicamenteuse a été effectuée chez des volontaires sains avec l’administration de 6 doses d’artéméther-luméfantrine réparties sur 60 heures. La cure était débutée 12 h après l’achèvement d’une cure de 3 doses de méfloquine ou de placebo. Les concentrations plasmatiques de méfloquine déterminées à partir de l’adjonction de du médicament n’étaient pas différentes de celles observées chez des patients ayant reçu un placebo après une cure de méfloquine.
Un traitement préalable par méfloquine n’a pas eu d’effet sur les concentrations plasmatiques d’artéméther ou sur le rapport des concentrations plasmatiques artéméther/dihydroartémisinine, mais une réduction significative des taux plasmatiques de luméfantrine a été observée, due probablement à une diminution de son absorption, elle-même secondaire à une diminution de la production biliaire induite par la méfloquine. Il doit être conseillé aux patients de prendre le médicament au cours d’un repas pour compenser la diminution de la biodisponibilité.
Quinine
Une étude d’interaction menée chez des hommes volontaires sains n’a pas révélé de modification des concentrations plasmatiques de luméfantrine et de quinine lorsque la quinine intraveineuse (10 mg/kg en 2 heures) était administrée de façon séquentielle 2 heures après la dernière dose (6ème dose) d’artéméther-luméfantrine (de manière à atteindre simultanément les concentrations plasmatiques maximales de luméfantrine et de quinine). Les taux plasmatiques d’artéméther et de dihydroartémisinine (DHA) retrouvés étaient diminués.
Dans cette étude, l’administration d’artéméther-luméfantrine chez 14 sujets n’a pas entraîné d’effet sur l’intervalle QTc. La perfusion de quinine en monothérapie chez 14 autres sujets a induit un allongement transitoire de l’intervalle QTc, compatible avec les effets cardiotoxiques connus avec la quinine. Cet effet était retrouvé légèrement, mais significativement, supérieur lorsque la quinine intraveineuse a été administrée après l’artéméther-luméfantrine à 14 autres sujets.
Il semble donc que le risque inhérent d’allongement de l’intervalle QTc associé à la quinine intraveineuse ait été majoré par l’administration préalable d’artéméther-luméfantrine.
Associations faisant l’objet de précautions d’emploi
Interactions affectant l’utilisation de Co-Artesiane®
Interactions avec les inhibiteurs du CYP3A4
L’artéméther et la luméfantrine sont tous deux métabolisés essentiellement par le cytochrome CYP3A4, mais aux concentrations thérapeutiques, il n’a pas été mis en évidence d’effet inhibiteur sur cette enzyme.
Kétoconazole
L’administration concomitante de kétoconazole par voie orale et d’artéméther-luméfantrine chez des volontaires sains adultes a entraîné une augmentation modérée (d’un facteur 2 ou moins) de l’exposition systémique à l’artéméther, à la DHA et à la luméfantrine. Cette augmentation de l’exposition systémique à chacun des antipaludiques n’a pas été associée à une augmentation des effets indésirables ou des modifications des paramètres électrocardiographiques.
Sur la base de cette étude, l’adaptation de la dose de d’artéméther-luméfantrine n’apparaît pas utile lors de l’administration concomitante avec du kétoconazole ou avec d’autres inhibiteurs puissants du CYP3A4 chez des patients impaludés par P. falciparum.
Co-Artesiane® doit être utilisé avec précaution avec les médicaments qui inhibent le CYP3A4 et est contre-indiqué avec les médicaments qui sont également connus pour allonger l’intervalle QTc, en raison de la possibilité d’augmentation des concentrations de luméfantrine pouvant conduire à un allongement de l’intervalle QT.
Interactions avec les inducteurs de CYP3A4 faibles à modérés
L’administration concomitante d’artéméther-luméfantrine avec des inducteurs modérés du CYP3A4 peut entrainer une diminution des concentrations d’artéméther et/ou luméfantrine et la perte de l’efficacité antipaludique.
Interactions avec les médicaments antirétroviraux tels que les inhibiteurs de la protéase et les inhibiteurs non nucléosidiques de la transcriptase inverse
L’artéméther et la luméfantrine sont tous deux métabolisés par le CYP3A4. Les ARV tels que les inhibiteurs de la protéase et les inhibiteurs non nucléosidiques de la transcriptase inverse sont connus pour avoir des profils d’activité variables d’inhibition, d’induction ou de compétition sur le CYP3A4. Artéméther-luméfantrine doit être utilisé avec précaution chez les patients sous antirétroviraux car une diminution des concentrations d’artéméther, de DHA, et/ou de luméfantrine peut entrainer une diminution de l’efficacité antipaludique du médicament, et une augmentation des concentrations de luméfantrine peut entrainer un allongement de l’intervalle QT.
Lopinovir/ritonavir
Dans une étude clinique chez des volontaires sains, le lopinavir et le ritonavir ont diminué d’approximativement 40% les expositions systémiques à l’artéméther et au DHA, mais ont augmenté d’approximativement 2 à 3 fois l’exposition à la luméfantrine. Les expositions au lopinavir et au ritonavir n’ont pas été significativement affectées par l’utilisation concomitante d’artéméther- luméfantrine.
Névirapine
Dans une étude clinique chez des adultes infectés par le VIH, la névirapine a significativement réduit le Cmax médian et l’aire sous la courbe (ASC) de l’artéméther d’approximativement 61% et 72% respectivement, et réduit le Cmax médian et l’ASC de la dihydroartémisinine d’approximativement 45% et 37% respectivement.
Le Cmax et l’ASC de la luméfantrine n’ont pas été réduits par la névirapine.
L’artéméther et la luméfantrine ont réduit le Cmax médian et l’ASC de la névirapine d’approximativement 43% et 46% respectivement.
Efavirenz
L’efavirenz diminue les expositions à l’artéméther, la DHA et la luméfantrine d’approximativement 50%, 45% et 20% respectivement. Les expositions à l’efavirenz ne sont pas significativement modifiées par l’utilisation concomitante d’artéméther-luméfantrine.
Interactions entraînant des effets de Co-Artesiane® sur d’autres médicaments
Interactions avec des médicaments métabolisés par les enzymes du CYP450
L’administration concomitante d’artéméther-luméfantrine avec des substrats du CYP3A4 peut entrainer une diminution de la concentration des substrats et une potentielle perte de leur efficacité.
Les études cliniques menées chez l’homme ont montré que l’artémisinine pouvait exercer un effet inducteur sur le CYP3A4 et le CYP2C19 et un effet inhibiteur sur le CYP2D6 et le CYP1A2. Même si les effets observés étaient de faible amplitude dans la majorité des cas, il est possible que ces effets entraînent une modification de l’effet thérapeutique des médicaments métabolisés essentiellement par l’action de ces enzymes.
Interactions avec les contraceptifs hormonaux
Des études menées in vitro n’ont pas montré d’induction du métabolisme de l’éthinylestradiol et du lévonorgestrel par l’artéméther, la DHA ou la luméfantrine. Cependant, il a été rapporté que l’artéméther induit faiblement l’activité du CYP2C19, CYP2B6 et CYP3A dans la population humaine.
Par conséquent, Co-Artesiane® peut potentiellement réduire l’efficacité des contraceptifs hormonaux. Les femmes utilisant des contraceptifs hormonaux par voie orale, dispositif transdermique ou autre contraceptif hormonal systémique doivent utiliser une méthode contraceptive supplémentaire non hormonale pendant environ un mois.
Interactions médicament-aliments/boissons
Co-Artesiane® doit être pris après ou au cours des repas ou avec une boisson riche en graisses telle que le lait afin d’améliorer l’absorption de l’artéméther et de la luméfantrine.
Le jus de pamplemousse doit être utilisé avec précaution pendant le traitement par Co-Artesiane®. L’administration d’artéméther avec du jus de pamplemousse chez des adultes sains a entrainé un doublement de l’exposition systémique à la molécule mère.
4.6. Fertilité, grossesse et allaitement
Fertilité
Aucune information n’est disponible concernant les effets d’ artéméther-luméfantrine sur la fertilité humaine.
Grossesse
L’utilisation de ce produit est contre-indiquée au cours du premier trimestre de la grossesse, car il a été prouvé dans des modèles animaux que l’artéméther peut provoquer des anomalies congénitales graves.
Au cours des deuxième et troisième trimestres, l’utilisation du produit n’est pas conseillée sauf si, selon l’avis du médecin, les bénéfices pour la mère l’emportent sur les risques pour le fœtus, comme c’est souvent le cas lors de paludisme cérébral et de paludisme compliqué.
Aucun cas d’embryotoxicité ou de tératogénicité n’a été signalé jusqu’à présent chez l’homme pour la combinaison d’artéméther et de luméfantrine.
Comme Co-Artesiane® a été conçue pour les enfants, il est peu probable que ce problème survienne.
Allaitement
Les données chez l’animal suggèrent un passage dans le lait maternel mais aucune donnée clinique humaine n’est disponible. Les femmes traitées par artéméther-luméfantrine ne doivent pas allaiter pendant leur traitement.
Du fait de la longue demi-vie d’élimination de la luméfantrine (2 à 6 jours), il est recommandé de respecter un délai d’au moins une semaine après la dernière prise de Co-Artesiane® avant de reprendre l’allaitement, sauf si les bénéfices potentiels pour la mère et l’enfant sont supérieurs aux risques du traitement par ce médicament.
Comme Co-Artesiane® a été conçue pour les enfants, il est peu probable que ce problème survienne.
4.7 Effets sur l’aptitude à conduire des véhicules et à utiliser des machines
Un risque d’étourdissements ou d’asthénie lié à la prise de Co-Artesiane® existe. Par conséquent la prudence est recommandée lors de la conduite et à l’utilisation de machines.
Comme Co-Artesiane® a été conçue pour les enfants, il est peu probable que ce problème survienne.
4.8. Effets indésirables
La maladie se caractérise par des symptômes désagréables qui ne doivent pas être confondus avec les effets secondaires du médicament. En général, les effets secondaires de ce médicament sont minimes. Les effets indésirables provoqués par l’artéméther sont généralement rares aux doses thérapeutiques.
La sécurité de l’association d’artéméther-lumefantrine a été évaluée au cours de multiples études cliniques incluant plus de 3500 patients. Un total de 1810 adultes et adolescents de plus de 12 ans ainsi que 1788 nourrissons et enfants âgés de 12 ans ou moins ont été traités par l’association d’artéméther-lumefantrine au cours des essais cliniques.
Les effets indésirables rapportés au cours des études cliniques et depuis la commercialisation des médicaments contenants l’association d’artéméther-lumefantrine sont listés ci-dessous selon des classes de systèmes d’organes.
Les effets indésirables sont classés par fréquence dans chaque classe (selon la classification MedDRA) :
- Très fréquent (≥ 1/10 cas) ;
- Fréquent (≥ 1/100 cas, <1/10 cas) ;
- Peu fréquent (≥ 1/1 000 cas, <1/100 cas) ;
- Rare (≥ 1/10 000 cas, <1/1 000 cas) ;
- Très rare (<1/10 000 cas) ;
- Fréquence indéterminée (ne peut être estimée sur la base des données disponibles).
| Classe de systèmes d’organes/Effet | Adultes et adolescents de plus de 12 ans | Enfants âgés de 12 ans ou moins (estimation d’incidence) |
|---|---|---|
| Affections du système immunitaire | ||
| Réactions d’hypersensibilité | Fréquence indéterminée | Rare |
| Troubles du métabolisme et de la nutrition | ||
| Perte d’appétit | Très fréquent | Très fréquent |
| Affections psychiatriques | ||
| Troubles du sommeil | Très fréquent | Peu fréquent |
| Insomnie | Fréquent | Peu fréquent |
| Affections du système nerveux | ||
| Céphalées | Très fréquent | Fréquent |
| Etourdissements | Très fréquent | Fréquent |
| Paresthésies | Fréquent | – |
| Ataxie, hypoesthésie | Peu fréquent | – |
| Somnolence | Peu fréquent | Peu fréquent |
| Mouvements cloniques | Fréquent | Peu fréquent |
| Affections cardiaques | ||
| Palpitations | Très fréquent | Fréquent |
| Allongement de l’intervalle QT sur l’électrocardiogramme | Fréquent | Rare |
| Affections respiratoires, thoraciques et médiastinales | ||
| Toux | Fréquent | Très fréquent |
| Affections gastro-intestinales | ||
| Vomissements | Très fréquent | Très fréquent |
| Douleurs abdominales | Très fréquent | Fréquent |
| Nausées | Très fréquent | Fréquent |
| Diarrhées | Fréquent | Fréquent |
| Affections hépatobiliaires | ||
| Anomalies du bilan hépatique | Peu fréquent | Fréquent |
| Affections de la peau et du tissu sous-cutané | ||
| Rash | Fréquent | Fréquent |
| Prurit | Fréquent | Peu fréquent |
| Urticaire | Peu fréquent | Peu fréquent |
| Angioedème* | Fréquence indéterminée | Fréquence indéterminée |
| Affections musculosquelettiques et systémiques | ||
| Arthralgies | Très fréquent | Fréquent |
| Myalgies | Très fréquent | Fréquent |
| Troubles généraux et anomalies au site d’administration | ||
| Asthénie | Très fréquent | Fréquent |
| Fatigue | Très fréquent | Fréquent |
* : Ces effets indésirables ont été rapportés depuis la commercialisation. Ces effets rapportés spontanément étant issus d’une population de taille inconnue, il est difficile d’estimer leur fréquence.
4.9 Surdosage
La dose recommandée ne doit pas être dépassée. En cas de surdosage accidentel, un traitement symptomatique d’urgence (dans un établissement spécialisé) est conseillé. L’électrocardiogramme et le taux de potassium sanguin (kaliémie) doivent être surveillés.
5. Propriétés pharmacologiques
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Antipaludique, Artémisinine et dérivés en association. Code ATC : P01BF01.
Co-Artesiane® est une thérapie combinée à base d’artéméther (TCA) qui contient deux substances actives qui agissent contre les parasites du paludisme. Co-Artesiane® comprend un ratio fixe de 1:6 parties d’artéméther et de luméfantrine, respectivement.
De tous les dérivés de l’artémisinine, l’artéméther (Β-artéméther) est le plus actif.
L’artémisinine, elle-même, est extraite de la plante Artemisia annua. L’artéméther est un produit semi-synthétique.
La luméfantrine est un alcool amino aryl synthétique similaire à la méfloquine et à l’halofantrine.
Grâce à cette association, l’artéméther tue les parasites très rapidement et potentialise les effets du second médicament, la luméfantrine.
Ce traitement combiné permet de raccourcir la durée du traitement et, ce faisant, d’améliorer son respect par le patient. L’administration d’un traitement combiné réduit de manière significative le risque théorique de résistance au médicament.
Chacune des substances actives exerce une activité au niveau de la vacuole digestive du parasite où elles semblent altérer la transformation de l’hème, produit de dégradation de l’hémoglobine toxique pour le parasite, en hémozoïne non toxique, pigment du Plasmodium.
La luméfantrine semble interférer avec le processus de polymérisation. L’artéméther produit des métabolites réactifs à la suite de l’interaction entre le pont peroxyde et le fer de l’hème. L’artéméther et la luméfantrine exercent une action secondaire, qui consister à bloquer la synthèse d’acides nucléiques et de protéines au sein du parasite paludéen.
5.2. Propriétés pharmacocinétiques
Absorption
L’artéméther est absorbé assez rapidement et la dihydroartémisinine (DHA), le métabolite actif de l’artéméther apparaît rapidement dans la circulation systémique avec, pour chacun d’eux, un pic de concentration plasmatique atteint environ 2 heures après l’administration orale.
L’absorption de la luméfantrine, composé hautement lipophile, débute dans les 2 heures suivant l’administration orale, le pic de concentration plasmatique étant atteint environ 6 à 8 heures après la prise.
La prise alimentaire augmente l’absorption de l’artéméther et de la luméfantrine. Chez des volontaires sains, lorsque l’association des actives était pris après un repas à haute teneur lipidique, les biodisponibilités relatives de l’artéméther et de la luméfantrine ont augmenté respectivement d’un facteur 2 et d’un facteur 16 comparativement à une prise à jeun.
Chez les sujets impaludés, une augmentation de l’absorption de la luméfantrine a également été observée avec la prise alimentaire. Cette augmentation n’était que d’un facteur 2, probablement du fait de la plus faible teneur en lipides des aliments ingérés par les patients lors de l’accès palustre. Les études d’interaction avec l’alimentation, ont mis en évidence une très faible absorption de la luméfantrine administrée chez des sujets à jeun (en supposant une absorption de 100 % après un repas riche en lipide, à jeun, le taux d’absorption serait inférieur à 10 % de la dose administrée).
Par conséquent, il conviendra de recommander au patient de prendre le traitement avec un repas normal dès que les aliments peuvent être tolérés.
Distribution
In vitro, la liaison de l’artéméther et de la luméfantrine aux protéines plasmatiques humaines est importante. La dihydroartémisinine se lie également aux protéines humaines sériques.
Biotransformation
Le métabolisme de l’artéméther est rapide (important effet de premier passage hépatique) aussi bien d’après les travaux in vitro que chez l’homme.
Dans les études réalisées sur microsomes hépatiques humains, l’artéméther est principalement métabolisé en dihydroartémisinine active (déméthylation) par l’iso-enzyme CYP3A4/5.
Ce métabolite a également été mis en évidence in vivo chez l’homme.
La dihydroartémisinine est ensuite métabolisée en composés inactifs.
La pharmacocinétique de l’artéméther chez l’adulte est temps-dépendante. Au cours de l’administration en doses répétées d’artéméther-luméfantrine, il est observé une décroissance des concentrations de l’artéméther au cours du temps alors que les concentrations du métabolite actif (dihydroartémisinine) augmentent nettement, sans toutefois atteindre le seuil de significativité statistique.
Ces observations suggèrent l’existence d’un phénomène d’induction au niveau de l’enzyme impliquée dans le métabolisme de l’artéméther. Un faible effet inducteur de l’artéméther et de la dihydroartémisinine sur le CYP3A4 a été décrit.
Dans les études réalisées sur microsomes hépatiques humains, la luméfantrine est N-débutylée principalement par l’isoenzyme CYP3A4. Dans les études réalisées in vivo chez l’animal (le chien et le rat), la luméfantrine est glucuroconjugée directement et après biotransformation oxydative.
Chez l’homme, l’exposition systémique à la luméfantrine augmente après une administration répétée d’artéméther-luméfantrine sur une période de traitement de 3 jours, ce qui est cohérent avec l’élimination lente du composé. L’exposition systémique observée pour le métabolite desbutyl-luméfantrine, dont l’effet antiparasitaire in vitro est 5 à 8 fois supérieur à celui de la luméfantrine, représentait moins de 1% de l’exposition systémique retrouvée par la molécule mère.
La pharmacocinétique de la desbutyl-luméfantrine n’a pas été documentée dans la population de sujets africains. In vitro, la luméfantrine inhibe de manière significative l’activité du cytochrome CYP2D6 aux concentrations plasmatiques thérapeutiques.
Élimination
L’artéméther et la dihydroartémisinine ont une demi-vie d’élimination plasmatique rapide d’environ 2 heures. La luméfantrine est quant à elle éliminée très lentement, avec une demi-vie d’élimination de 2 à 6 jours. Le sexe et le poids semblent n’avoir aucun effet cliniquement significatif sur la pharmacocinétique d’artéméther-luméfantrine.
Des données limitées concernant l’excrétion urinaire chez l’homme sont disponibles. Chez 16 volontaires sains, il n’a pas été retrouvé de luméfantrine ni d’artéméther dans les urines après administration d’artéméther-luméfantrine, et seules des traces de dihydroartémisinine ont été détectées (l’excrétion urinaire de dihydroartémisinine s’élevait à moins de 0,01% de la dose d’artéméther).
Chez l’animal (rat et chien), aucune quantité d’artéméther sous forme inchangée n’a été détectée ni dans les fèces ni dans les urines, en raison de l’effet de premier passage hépatique rapide et extensif, mais certains métabolites (partiellement identifiés) ont été décelés dans les fèces, la bile et les urines.
La luméfantrine a été excrétée sous forme inchangée dans les fèces et seulement sous forme de traces dans les urines. Des métabolites de la luméfantrine ont été éliminés dans la bile/les fèces.
Relation effet-dose
Il n’a pas été mené d’études effet-dose spécifiques. Des données limitées suggèrent une augmentation de l’exposition systémique à la luméfantrine proportionnelle à la dose lors du doublement de la dose d’artéméther-luméfantrine. Aucune donnée concluante n’est disponible pour l’artéméther.
Population pédiatrique
Chez les patients enfants atteints de paludisme, la moyenne de la Cmax (CV%) de l’artéméther (observée après la première prise d’artéméther-luméfantrine était de 223 (139%), 198 (90%) et 174 ng/mL (83%) respectivement pour les groupes de poids corporel 5-<15, 15-<25 et 25-<35 kg par rapport à 186 ng/mL (67%) chez les patients adultes.
La moyenne de la Cmax de la DHA associée était respectivement de 54,7 (108%), 79,8 (101%) et 65,3 ng/mL (36%) par rapport à 101 ng/mL (57%) chez les patients adultes.
L’aire sous la courbe (ASC) des concentrations plasmatiques de la luméfantrine (moyenne de la population recevant 6 doses d’artéméther-luméfantrine était de 577, 699 et 1150 µg h/mL pour les patients enfants respectivement pour les groupes de poids corporel 5-<15, 15-<25 et 25-<35 kg par rapport à la moyenne de l’ASC de 758 µg h/mL chez les patients adultes.
Les demi-vies d’élimination de l’artéméther et de la luméfantrine chez les enfants ne sont pas connues.
Insuffisants rénaux et hépatiques
Il n’a pas été mené d’étude spécifique de pharmacocinétique chez les patients présentant une insuffisance hépatique et rénale ou chez les patients âgés.
Le mécanisme principal de clairance de l’artéméther et de la luméfantrine peut être affecté chez les patients atteints d’insuffisance hépatique.
Chez les patients atteints d’une insuffisance hépatique sévère, une augmentation cliniquement significative de l’exposition à l’artéméther et à la luméfantrine et/ou à leurs métabolites ne peut être exclue.
Par conséquent, la prudence est requise dans le choix de la dose chez les patients insuffisants hépatiques sévères.
Des données de pharmacocinétique obtenues chez 16 volontaires sains, n’ont pas montré d’excrétion rénale de luméfantrine, d’artéméther et de dihydroartémisinine, ou seulement une excrétion rénale négligeable.
Ainsi, aucun ajustement posologique lors de l’utilisation de Co-Artesiane® n’est recommandé chez des patients présentant une insuffisance rénale.
5.3. Données de sécurité préclinique
Toxicité générale
Les principaux effets observés dans les études en administration réitérée sont liés à l’action pharmacologique au niveau des érythrocytes et à l’hématopoïèse réactionnelle.
Neurotoxicité
Des études menées chez le chien et le rat ont montré que des injections intramusculaires d’artéméther sont à l’origine de lésions cérébrales. Celles-ci ont principalement été observées au niveau des noyaux du tronc cérébral incluant chromatolyse, granulation cytoplasmique éosinophile, sphéroïdes, apoptose et neurones assombris.
Ces lésions ont été observées chez des rats ayant reçu ces doses pendant au moins 7 jours et chez des chiens pendant au moins 8 jours, mais pas après des durées d’administrations intramusculaires plus courtes ni après une administration orale. L’aire sous la courbe (ASC) 24h estimée de l’artéméther après 7 jours d’administration à la dose sans effet observé est approximativement 7 fois supérieure ou plus à l’ASC 24h estimée de l’artéméther chez l’homme.
Le seuil d’audition était affecté dès 20 Db par l’administration d’artéméther par voie orale à des chiens dont la dose administrée équivaut à environ 29 fois la plus forte dose clinique d’artéméther (160 mg/jour), en se basant sur la comparaison des surfaces corporelles.
La plupart des évènements indésirables mis en évidence au niveau du système nerveux dans les études avec une administration en 6 prises étaient d’intensité faible et résolus à la fin de l’étude.
Mutagénicité
Des tests in vitro et in vivo n’ont pas mis en évidence d’effet génotoxique/clastogénique de l’association artéméther-luméfantrine.
Cancérogénèse
Il n’a pas été mené d’étude de cancérogénèse.
Etude des fonctions de reproduction
Un effet embryotoxique a été mis en évidence dans les études de toxicité sur la reproduction menées chez le rat et le lapin avec l’artéméther, un dérivé de l’artémisinine.
Les dérivés de l’artémisinine sont connus pour être embryotoxiques. Avec la luméfantrine administrée seule, il n’a pas été observé de signes de toxicité sur la reproduction ou le développement chez les rats et les lapins à des doses allant jusqu’à 1 000 mg/kg/jour, soit, des doses au moins 10 fois supérieures à la dose journalière chez l’homme en se basant sur la comparaison des surfaces corporelles.
Les études de toxicité sur la reproduction menées chez les rats et les lapins avec l’association artéméther-luméfantrine ont mis en évidence une toxicité maternelle et une augmentation des pertes post-implantatoires.
L’artéméther a induit des augmentations de pertes post-implantatoires et une tératogénicité (caractérisée par une faible incidence de malformations cardiovasculaires et squelettiques) chez les rats et chez les lapins.
La dose embryotoxique d’artéméther chez le rat a induit des expositions à l’artéméther et à la dihydroartéinisinine comparables à celles obtenues chez l’homme en se basant sur l’ASC.
Fertilité
L’administration d’artéméther-luméfantrine a entrainé une altération de la mobilité des spermatozoïdes, des spermatozoïdes anormaux, une diminution du nombre de spermatozoïdes épididymaires, une augmentation du poids des testicules et une embryotoxicité ; d’autres effets sur la reproduction (diminution du nombre d’embryons implantés et d’embryons viables, augmentation des pertes préimplantatoires) ont également été observés.
La dose sans effet sur la fertilité était de 300 mg/kg/jour. La pertinence de ces résultats chez l’homme est inconnue.
Etude de toxicité chez les jeunes animaux
Une étude a évalué la neurotoxicité de l’artéméther par voie orale chez des jeunes rats. La mortalité, les signes cliniques et la réduction des paramètres du poids corporel sont survenus plus particulièrement chez les plus jeunes rats.
Malgré la toxicité systémique observée, il n’y avait pas d’effets de l’artéméther sur aucun des tests fonctionnels réalisés et il n’y avait aucune preuve d’un effet neurotoxique chez les jeunes rats. Les très jeunes animaux sont plus sensibles aux effets toxiques de l’artéméther que les animaux adultes. Il n’y aucune différence de sensibilité chez les rats légèrement plus âgés comparé aux rats adultes.
Les études cliniques ont établi la sécurité d’emploi de l’artéméther et de la luméfantrine chez les patients pesant 5kg et plus.
Pharmacologie de sécurité cardiaque
Dans les études de toxicité menées chez le chien à des doses supérieures ou égales à 600 mg/kg/jour, doses plus élevées que les doses thérapeutiques recommandées chez l’homme, des allongements de l’intervalle QTc (marge de sécurité pour l’artéméther de 1,3 à 2,2 fois estimée en utilisant la Cmax libre calculée) ont été observés.
Des essais in vitro hERG ont montré une marge de sécurité >100 pour l’artéméther et la dihydroartémisinine. L’IC50 hERG était de 8,1 µM pour la luméfantrine et 5,5 µM pour son métabolite desbutyl.
Sur la base des données non cliniques disponibles, le risque d’allongement de l’intervalle QTc ne peut pas être écarté chez l’homme. Pour les effets dans l’homme, voir les sections 4,3, 4,4 et 5,1.
6. Données pharmaceutiques
6.1 Liste des excipients
- Saccharose ;
- Cellulose microcristalline et carmellose sodique ;
- Acide citrique ;
- Gomme de xanthane ;
- Parahydroxybenzoate de méthyle ;
- Parahydroxybenzoate de propyle ;
- Arôme de noix de coco ;
- Silice colloïdale, anhydre
6.2 Incompatibilités
Sans objet.
6.3 Stabilité et conditions de conservation
Durée de conservation
24 mois.
Après la reconstitution : 28 jours.
Conditions de conservation
Conserver à une température ne dépassant pas 30 ° C, dans l’emballage d’origine protégé de la lumière et l’humidité.
6.4 Précautions particulières de conservation
Après la reconstitution : conserver le flacon dans un endroit sombre pour protéger de la lumière. Secouez bien la bouteille avant chaque utilisation.
6.5 Nature du conditionnement primaire et contenu de l’emballage extérieur
- Co-Artesiane® 60 ml : Boîte d’un flacon en verre transparent (Type III) marqué à 60 ml, contenant 22, 8 g de poudre jaune, fermée par un bouchon-à-vis en plastique ;
- Co-Artesiane® 120 ml : Boîte d’un flacon en verre transparent (Type III) marqué à 120 ml, contenant 45,6 g de poudre jaune, fermée par un bouchon-à-vis en plastique.
Chaque emballage contient un bécher en plastique transparent, gradué avec marques à intervalles de 1 ml et des intervalles de 5 ml.
Les deux présentations peuvent ne pas être commercialisées dans chaque pays.
6.6 Précautions particulières d’élimination et manipulation
Pas d’exigences particulières pour l’élimination.
Tout produit non utilisé ou déchet doit être éliminé conformément à la règlementation en vigueur.
7. Inscription à une liste des substances vénéneuses
Liste I : uniquement sur ordonnance.
8. Fabricant
MPF bv, Appelhof 13, 8465 RX Oudehaske, Pays-Bas.
9. TITULAIRE DE L’ENREGISTREMENT
Dafra Pharma GmbH
Mühlenberg 7, 4052 Bâle, Suisse.
10. Date de la dernière révision du texte
Mai 2019.
Dernière mise à jour de cette page
05/11/2019.