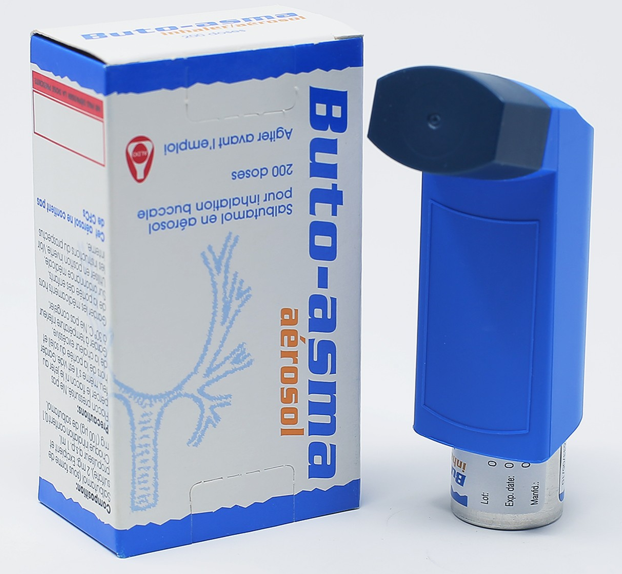
Buto-Asma® HFA aérosol
1 – DÉNOMINATION DU MEDICAMENT
Buto-Asma® HFA aérosol.
2 – COMPOSITION QUALITATIVE ET QUANTITATIVE
Par 100 ml :
Principe actif
Salbutamol sulfate : 0.2400 g
Excipients
- Éthanol : 6.0000 g ;
- Acide oléique : 0.02500 g ;
- 1,1,1,2 Tetrafluoroethane (HFA-134a) : 113.4741 g.
3 – FORME PHARMACEUTIQUE
Aérosol.
4 – DONNÉES CLINIQUES
4.1 Indications thérapeutiques
Amélioration du bronchospasme associé à l’asthme, à la bronchite ou à l’emphysème.
4.2 Posologie et mode d’administration
Prise par voie orale.
Mode d´emploi recommandé :

- A. Enlever le couvercle de la pièce buccale (figure 1) ;
- B. Tenir l´inhalateur de la manière indiquée dans la figure 2 ;
- C. Agiter le flacon pendant 20 secondes (figure 2) ;
- D. Introduire l´embout dans la bouche, expirer le plus d´air possible des poumons et refermer vos lèvres sur celui-ci (Figure 3) ;
- E. Faire une inspiration la plus profonde possible. Pendant l´inspiration presser l´appareil selon la direction indiquée dans la figure 4 ;
- F. Retirer l´inhalateur de la bouche et retenir l´air dans les poumons pendant quelques secondes ;
- G. Si une autre inhalation est nécessaire, attendre quelques secondes avant de répéter les étapes C, D, E et F ;
- H. Remettre le couvercle sur l´embout buccal.
Nettoyer souvent l´embout buccal de l´aérosol. Pour nettoyer, enlever le flacon métallique et laver l´adaptateur dans l´eau savonneuse tiède (pas chaude). Rincer à fond, sécher l´adaptateur et réassembler l´unité de sorte qu´elle soit prête a l´emploi. Après le réassemblage, remettre le couvercle.
Posologie
Adultes
- Pour une amélioration immédiate : 1 à 2 inhalations ;
- Pour un traitement chronique ou préventif : 2 inhalations 3 ou 4 fois par jour ;
- Pour prévenir l’asthme par effort : 2 inhalations avant l’exercice.
Enfants
- Pour une amélioration immédiate ou avant l’exercice : 1 inhalation ;
- Pour un traitement préventif ou chronique : 1 inhalation 3 ou 4 fois par jour; si nécessaire, la dose peut être augmentée à 2 inhalations 3 ou 4 fois par jour.
4.3 Contre-indications
Administrer avec précaution chez les patients ayant de l’hypertension, de l’insuffisance cardiaque ou de la thyrotoxicose.
4.4 Mises en garde spéciales et précautions d’emploi
- Les patients doivent être avisés de consulter un médecin s’ils ressentent une détérioration de la fonction cardiaque ou du système vasculaire ;
- Ce médicament doit être administré avec prudence aux patients atteint d’hypertension, hyperactivité de la glande thyroïdienne, hypertrophie de la prostate ou en cas d´existence actuelle ou passée de spasmes ;
- Ce médicament ne devrait pas s’utiliser durant la grossesse à moins que les bienfaits priment les risques ;
- En cas d’allaitement ou de désir d’allaitement et compte-tenu du passage des bêta-2-mimétiques dans le lait maternel, l’utilisation de ce médicament est à éviter. Elle expose le nouveau-né à une accélération du rythme cardiaque et à une hyperglycémie.
Utilisation chez les athlètes
Les athlètes doivent être avertis que ce médicament contient du salbutamol, qui peut produire un résultat positif aux tests de contrôle du dopage.
4.5 Interactions avec d’autres médicaments et autres formes d’interactions
Le salbultamol ne peut être administré avec l’un des médicaments ci-après : les antidépresseurs tricycliques (par ex. l’amitriptyline, la désipramine, la nortriptyline); l’atomoxétine; les bêtabloquants (par ex. le propranolol, le nadolol, le sotalol); d’autres bronchodilatateurs (par ex. le salmétérol, la terbutaline) ; la caféine ; le carvédilol ; certains diurétiques (par ex. l’hydrochlorothiazide, le furosémide) ; la dextroamphétamine ; la digoxine ; la dobutamine ; la dopamine ; l’épinéphrine ; les inhibiteurs de la monoamine-oxydase (par ex. la phénelzine, la tranylcypromine, le moclobémide) ; le labétalol ; le méthylphénidate ; la pseudoéphédrine.
D’autres médicaments que ceux énumérés précédemment peuvent interagir avec ce médicament. Le salbutamol ne peut être administré simultanément avec :
- d’autres bronchodilatateurs béta-adrénergiques, pour éviter un éventuel complément d´effets ;
- de l´imipramine, chlopromazine ou chlordiazépoxyde.
4.6 Fertilité, grossesse et allaitement
Grossesse
Les études effectuées chez l’animal n’ont pas mis en évidence d’effet tératogène ou foetotoxique du salbutamol. En clinique, l’analyse d’un nombre élevé de grossesses exposées n’a apparemment révélé aucun effet malformatif ou fœtotoxique du salbutamol. Ce médicament ne devrait pas s’utiliser durant la grossesse à moins que les bienfaits priment les risques.
Allaitement
L’utilisation de ce médicament est à éviter durant la période d’allaitement compte-tenu du passage des bêta-2-mimétiques dans le lait maternel,. Elle expose le nouveau-né à une accélération du rythme cardiaque et à une hyperglycémie.
4.7 Effet sur l’aptitude à la conduite et l’utilisation de machines
Ce médicament peut affecter l’aptitude à conduire des véhicules et à utiliser des machines chez les patients présentant des effets indésirables ; en particulier lors de la prise de fortes doses, surtout en début du traitement ou lorsque l’administration de ce produit est simultanée à la prise d’alcool. En raison de possible effets secondaires tels que des crampes musculaires passagères et des tremblements, des précautions pourraient être nécessaire lors de l’utilisation de machines.
4.8 Effets indésirables
Aux doses normales, le produit est dépourvu d´effets secondaires. À des doses très élevées, il peut provoquer des tremblements musculaires légers, surtout dans les mains, par action directe sur le muscle squelettique. Ce tremblement n´est pas provoqué par stimulation directe du système nerveux central. Dans certains cas, très rares, on a décrit une certaine tachycardie.
4.9 Surdosage
Les symptômes de surdosage correspondent à l’amplification de l’intensité et de la gravité des effets indésirables (voir rubrique Effets indésirables). Les symptômes caractéristiques sont : tachycardie, palpitations, arythmie, agitation, troubles du sommeil, douleur thoracique et tremblements des extrémités pouvant s’étendre à l’ensemble du corps.
Des réactions psychotiques ont été observées occasionnellement après administration de doses excessives de salbutamol.
Le surdosage en salbutamol peut entrainer une augmentation de l’entrée du potassium dans les cellules qui provoque une hypokaliémie, une hyperglycémie, une hyperlipidémie et une cétose.
Le traitement d’un surdosage en agonistes des récepteurs béta sympathomimétiques est essentiellement symptomatique.
La conduite à tenir sera fonction du cas clinique.
Si une grande quantité de médicaments a été ingérée, un lavage gastrique peut être envisagé. Le charbon actif et les laxatifs peuvent éventuellement contribuer, par diminution de l’absorption, à un moindre passage systémique des sympathomimétiques.
En cas d’hypotension importante, une voie d’abord avec remplissage vasculaire devra être instaurée.
En cas d’hypokaliémie, la surveillance de l’ionogramme avec éventuellement, si nécessaire, un apport électrolytique est recommandé.
5 – PROPRIÉTÉS PHARMACOLOGIQUES
5.1. Propriétés pharmacodynamiques
Classe thérapeutique : R03A C02.
Classe pharmacologique : Famille : bronchodilatateurs.
Le Salbutamol est un stimulant béta-adrénergique sélectif, puisqu´il agit de préférence sur les récepteurs bêta-2, tandis que son action sur les récepteurs béta-1 est nulle ou très faible. Ceci fait que le produit a une action bronchiale sélective, sans agir sur le système cardiaque, les récepteurs bêta-1 étant présents dans le myocarde et les bêta-2 dans les muscles lisses bronchiaux et vasculaires. Cette action sélective représente un avantage clinique important. Le Salbutamol est bien absorbé par voie orale et il a un effet prolongé. L’action broncospasmolytique prolongée et de désobstruction des bronches du Salbutamol représente une aide précieuse pour le malade asthmatique.
5.2. Propriétés pharmacocinétiques
Après inhalation, seulement 10% ou moins du médicament sont déposés dans les voies respiratoires, le reste est avalé. Le Salbutamol est bien absorbé par le tractus gastro-intestinal. Le métabolisme présystémique du Salbutamol est important et a lieu principalement dans le tractus gastro-intestinal ou il forme par conjugaison un ester de sulfate inactif.
En raison de son absorption progressive dans les bronches, les niveaux systémiques du Salbutamol sont faibles après inhalation de la dose recommandée. Les concentrations plasmatiques de Salbutamol atteignent un pic après 2-4 heures.
La clairance systémique du Salbutamol est de 30 litres/heures. Il est éliminé par excrétion urinaire sous forme de produit inchangé ou il est métabolisé sous forme de dérivés sulfoconjugués. La demi-vie d’élimination varie de 3 à 7 heures. Environ 72% de la dose inhalée est excrété dans les urines en 24 heures, 28% sous forme inchangée et 44% sous forme métabolisée.
Les résultats obtenus chez l’animal montrent que le Salbutamol ne traverse pas la barrière hémato-encéphalique.
5.3. Données de sécurité précliniques
Les données précliniques basées sur des études conventionnelles sur la sécurité pharmacologique, la toxicité à doses répétées et la génotoxicité n’ont pas révélé de risque particulier chez l’homme. Les données de tératogénicité trouvées chez les lapins exposés à des doses systémiques élevées ou l’induction de leyomiomes bénins de la mésovaryse chez le rat ne sont pas considérées comme cliniquement pertinentes.
6 – DONNEES PHARMACEUTIQUES
6.1. Liste des excipients
Éthanol, Acide oléique, 1,1,1,2 Tetrafluoroethane (HFA-134a).
6.2. Incompatibilités
Bêta-bloquants adrénergiques.
Eviter l’administration simultanée avec d’autres bronchodilatateurs béta-adrénergiques, pour éviter un éventuel complément d´effets. On déconseille aussi l’administration d´imipramine, chlopromazine ou chlordiazépoxyde.
6.3. Durée de conservation
3 ans à partir de la date de fabrication.
6.4. Précautions particulières de conservation
Conserver à moins de 30°C.
Garder hors de la portée de la lumière solaire directe.
Ne pas congeler.
6.5. Nature et contenu de l’emballage extérieur
Flacon aérosol d’aluminium de 200 doses équipé avec metered dose valve, embout buccal et bouchon. Le flacon aérosol et la notice sont conditionnés dans une boîte en carton.
6.6. Précautions particulières d’élimination et de manipulation
L’élimination sera faite conformément aux exigences locales.
7 – TITULAIRE DE L’AUTORISATION DE MISE SUR LE MARCHE
LABORATORIO ALDO-UNIÓN, S.L.
Baronesa de Maldá, 73
08950 Esplugues de Llobregat
Barcelona – Spain
8 – NUMERO(S) D’AUTORISATION DE MISE SUR LE MARCHE
N/A
9 – DATE DE PREMIERE AUTORISATION/RENOUVELLEMENT DE L’AUTORISATION
N/A
10. DATE DE RÉVISION DU TEXTE
12 mars 2020.
Dernière mise à jour de cette page
30/11/2020.