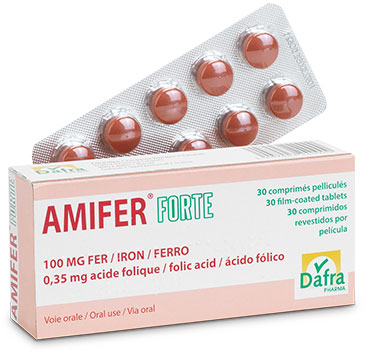
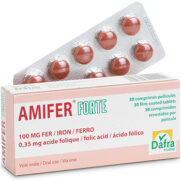
Amifer®Forte
1. Dénomination du médicament
Amifer® Forte
2. Composition qualitative et quantitative
Un comprimé contient 100 mg de fer élémentaire (sous forme de complexe d’hydroxyde ferrique – polymaltose) et 0,350 mg d’acide folique.
Excipient(s) à effet notoire : la pellicule du comprimé contient 0.1 mg de rouge ponceau 4R (E124).
Pour la liste complète des excipients, voir rubrique 6.1.
3. Forme pharmaceutique et présentation
Comprimés pelliculés rouge-marron, ronds, biconvexes.
Boîte de 30 comprimés pelliculés.
4. Données cliniques
4.1 Indications thérapeutiques
AMIFER® Forte est un supplément de Fer. Chaque comprimé contient 100 mg de fer élémentaire et 0,350 mg d’acide folique. AMIFER® Forte est un produit appartenant à la classe des antianémiques utilisé pour prévenir et corriger des carences en Fer avant et pendant le stade de l’anémie ferriprive ainsi que dans la prévention et le traitement des carences en fer et acide folique durant la grossesse et l’allaitement.
4.2. Posologie et mode d’administration
Posologie
Posologie pour le traitement d’anémie sévère
La dose normale recommandée d’Amifer Forte est de 1 comprimé par jour.
Si le médecin le juge nécessaire, 1 comprimé pourra être pris deux fois par jour.
La durée du traitement est déterminée par le médecin.
Après l’élimination clinique des symptômes de carence en fer, l’utilisation d’Amifer® Forte doit être poursuivie pendant au moins un mois supplémentaire (pour réapprovisionner les réserves en fer).
- Population gériatrique : des doses normales peuvent être utilisées ; il n’est pas nécessaire d’ajuster la posologie.
- Insuffisance rénale/hépatique: Amifer® Forte ne doit pas être utilisé en cas d’affections graves du foie ou des reins.
Mode d’administration
Voie orale.
Amifer® Forte doit être pris avec ou après un repas.
4.3. Contre-indications
Amifer® Forte est contre-indiqué chez les patients présentant :
- une hypersensibilité au fer, l’acide folique ou à l’un des excipients mentionnés à la rubrique 6.1 ;
- des affections entraînant une surcharge en fer (hémochromatose, hypersidérose, hémolyse chronique) ;
- toutes les anémies qui ne sont pas due à une carence en fer (comme une anémie hémolytique ou anémie mégaloblastique par carence en vitamine B12)
- une thalassémie ;
- des affections graves du foie ou des reins ;
- des affections nécessitant des transfusions sanguines régulières et continues ;
- une infection par le VIH sans anémie ferriprive cliniquement prouvée.
4.4. Mises en garde et précautions particulières d’emploi
- Une anémie doit toujours être traitée sous la surveillance d’un médecin.
- En cas d’anémie ferriprive et de traitement oral par le fer, le taux d’hémoglobine augmente de 1 à 2 g/dl en 2 à 4 semaines. Par conséquent, une numération globulaire est requise 2 à 4 semaines après le début du traitement.
- Les patients recevant des transfusions sanguines répétées doivent être mis en garde contre la surcharge en fer, car chaque unité de sang total contient environ 250 milligrammes de fer.
- La prudence est de mise chez les patients alcooliques ou présentant une inflammation intestinale.
- La prudence est de mise chez les patients présentant un ulcère gastrique.
- Lors de l’administration de préparations orales à base de fer, la couleur des selles peut s’assombrir ; cela est normal et ne nécessite aucune mesure. Cela n’entraînera pas de résultats faussement positifs lors de tests visant à détecter la présence de sang occulte dans les selles. Il n’est donc pas nécessaire d’interrompre le traitement pendant ce test.
- En cas d’anémie associée à une infection ou à une tumeur maligne, le fer administré est stocké dans le système réticulo-endothélial et est utilisé lors de la mobilisation après le traitement de l’affection primaire.
- Le comprimé contient de l’acide folique et peut ainsi masquer une carence en vitamine B12. Compte-tenu du risque de troubles neurologiques irréversibles, il convient d’exclure avant le début du traitement chez un patient anémique toute carence éventuelle en vitamine B12 (voir rubrique 4.3).
- L’administration accidentelle de produits contenant du fer peut causer une toxicité fatale chez les enfants de moins de 6 ans. En cas de surdosage, les patients doivent consulter rapidement un médecin ou un centre antipoison.
- La pellicule du comprimé Amifer® Forte contient du Rouge Ponceau 4R, qui peut provoquer des réactions allergiques.
4.5. Interactions avec d’autres médicaments et autres formes d’interactions
Puisque l’ion de fer III du complexe d’hydroxyde ferrique-polymaltose est un ion complexe, aucune interaction ionique avec des aliments ou des médicaments concomitants (tétracyclines, anti-acides) ne devrait se produire.
Cependant, en raison de la possibilité d’une interaction avec des formulations contenant du calcium, il convient de laisser s’écouler au moins 2 heures entre l’administration de calcium et celle de fer.
4.6. Fertilité, grossesse et allaitement
Fertilité
Aucun effet d’Amifer® Forte sur la fertilité n’a été déterminé.
Grossesse
Catégorie de grossesse : A
Ce médicament est utilisé comme supplément de fer et acide folique pendant la grossesse.
Des études épidémiologiques bien contrôlées ont montré que le complexe d’hydroxyde ferrique-polymaltose n’a pas d’effets indésirables sur la santé du fœtus/nouveau-né ou sur la grossesse ; Amifer® Forte peut donc être utilisé durant la grossesse.
Allaitement
Ce médicament est utilisé comme supplément de fer et acide folique pendant l’allaitement.
Le fer est excrété dans le lait maternel. Cette excrétion ne change pas quelles que soient la teneur en fer de la mère et la quantité de fer consommée avec la nourriture. Par conséquent, l’administration de formulations à base de fer à la mère allaitante n’entraîne pas d’intoxication au fer chez le bébé et n’élimine pas une carence en fer existante chez le bébé.
Amifer® Forte peut être utilisé pendant l’allaitement.
4.7. Effet sur l’aptitude à la conduite et l’utilisation de machines
Amifer® Forte n’a pas d’effet sur l’aptitude à conduire des véhicules ou à utiliser des machines.
4.8. Effets indésirables
Très fréquent (≥ 1/10) ; fréquent (≥ 1/100 à 1/10) ; peu fréquent (≥ 1/1000 à 1/100) ; rare (≥ 1/10.000 à 1/1000) ; très rare (< 1/10.000) ; fréquence indéterminée (ne peut être déterminée à partir des données disponibles).
| Peu fréquent( ≥ 1/1000 à < 1/100) |
Rare (≥ 1/10.000 à < 1/1000) |
Très rare (< 1/10.000) |
|
|---|---|---|---|
| Affections du système immunitaire | Réactions allergiques, asthme | ||
| Affections du système nerveux | Sensation de satiété, Sensation de lourdeur épigastrique, Nausées, Constipation, Diarrhée, Douleurs abdominales, Vomissements | ||
| Affections de la peau et du tissu sous-cutané | Urticaire, Éruptions cutanées, Exanthème, Démangeaisons |
Réactions cutanées localisées | |
| Affections du rein et des voies urinaires | Modification de la couleur de l’urine (remarque : on observe fréquemment une décoloration des selles liée au fer) |
L’hydroxyde ferrique-polymaltose ne colore pas les dents et ne cause pas de goût métallique dans la bouche tel que cela est observé avec les préparations à base de sel de fer ionisé bivalent.
4.9 Surdosage
En cas de surdosage, une intoxication ou une surcharge en fer, des douleurs épigastriques, une diarrhée et des vomissements peuvent être observés (ainsi qu’une acidose métabolique, des convulsions et un coma dans les cas plus graves).
Il a été rapporté qu’une dose excessive d’acide folique pouvait provoquer des modifications du système nerveux central (c’est-à-dire des troubles, des modifications du rythme du sommeil, une irritabilité et une hyperactivité), des nausées, des tensions abdominales et des flatulences.
En cas de surdosage, il est recommandé d’utiliser de la desferrioxamine (d’abord 1000 mg puis 500 mg toutes les 4 heures, jusqu’à 2 doses par voie IV) ou de l’EDTA de calcium et de disodium (167 mg/m2 toutes les 4 heures par voie IM, sous la forme de 1 mg/m2 par voie IV en perfusion de 8-24 heures ou toutes les 12 heures) (la desferrioxamine a des effets tératogènes).
5. Propriétés pharmacologiques
5.1. Propriétés pharmacodynamiques
Classe pharmacothérapeutique : Sang et organes hématopoïétiques, Préparations anti-anémiques, Fer en combinaison avec de l’acide folique, complexes d’oxyde ferrique-polymaltose
Code ATC : B03AD04
Amifer® Forte contient 100 mg de fer sous forme d’hydroxyde ferrique – polymaltose et 0,350 mg d’acide folique. Cette combinaison a été élaborée pour prévenir et traiter les carences en fer et en acide folique.
Le fer se trouve dans toutes les cellules de l’organisme et a des fonctions vitales. Il est présent dans la structure des enzymes (cytochrome oxydase, xanthine oxydase, déshydrogénase succinique), lesquelles jouent un rôle dans le transfert d’énergie. En cas de carence en fer, une déficience de ces fonctions vitales est observée.
Grâce à l’utilisation de fer pendant la grossesse et l’allaitement, les besoins croissants en fer de la mère et du nourrisson sont satisfaits. En outre, s’il y a une carence, celle-ci est traitée.
L’acide folique (vitamine B9) est transformé en tétrahydrofolate in vivo et joue un rôle dans divers processus métaboliques, y compris la synthèse des nucléotides de purine et de pyrimidine ainsi que la copie et la synthèse de l’ADN connexe, ce qui produit de nouvelles cellules et renforce les systèmes nerveux et immunitaire.
Les carences en acide folique peuvent être un problème grave pouvant causer différents problèmes de santé (fonction immunitaire affaiblie, manque d’énergie chronique, mauvaise digestion, problèmes de développement pendant la grossesse et la petite enfance, anémie, plaies dans la bouche et changements d’humeur).
Apports journaliers recommandés (AJR)
1 µg de folate équivaut à 0,6 µg d’acide folique.
| Tranche d’âge | Fer (mg) | Folate (µg/jour) |
|---|---|---|
| Enfants | ||
| 0 à 6 mois | 6 | 65 |
| 7 à 12 mois | 10 | 80 |
| 1 à 3 ans | 10 | 150 |
| 4 à 6 ans | 10 | 200 |
| 7 à 10 ans | 10 | 200-300 |
| Femmes | ||
| 11 à 14 ans | 15 | 300 |
| 15 à 18 ans | 15 | 400 |
| 19 à 50 ans | 15 | 400 |
| > 51 ans | 10 | 400 |
| Femmes enceintes | 30 | 600 |
| Femmes allaitantes | 15 | 500 |
| Hommes | ||
| 11 à 14 ans | 12 | 300 |
| 15 à 18 ans | 12 | 400 |
| 19 à 50 ans | 10 | 400 |
| > 51 ans | 10 | 400 |
Dose journalière maximale autorisée
1 µg de folate équivaut à 0,6 µg d’acide folique.
| Tranche d’âge | Folate (µg/jour) |
|---|---|
| Enfants | |
| 0 à 6 mois | ND |
| 7 à 12 mois | ND |
| 1 à 3 ans | 300 |
| 4 à 6 ans | 400 |
| 7 à 10 ans | 400-600 |
| Hommes et femmes | |
| 11 à 14 ans | 600 |
| 15 à 18 ans | 800 |
| 19 à 50 ans | 1000 |
| > 51 ans | 1000 |
| Femmes enceintes | 30600 |
| ≤ 18 ans | |
| 19 à 50 ans | |
| Femmes allaitantes | |
| ≤ 18 ans | |
| 19 à 50 ans | |
ND : Non Défini
5.2. Propriétés pharmacocinétiques
Fer
Caractéristiques générales
Dans la molécule du complexe d’hydroxyde ferrique – polymaltose, les noyaux d’hydroxyde ferrique sont entourés de molécules de polymaltose qui sont liées superficiellement par des liaisons non covalentes. Par conséquent, dans un environnement physiologique, le fer ionique n’est pas libéré et une absorption efficace est obtenue.
Absorption
Le fer est absorbé par les intestins dans le duodénum et le jéjunum proximal. L’absorption du fer par les intestins varie en fonction de la personne et de la carence en fer. Le besoin journalier en fer d’un adulte normal est de 0,5 à 1 mg. Cette valeur peut augmenter de 1 à 2 mg par jour chez les femmes en période de menstruation.
Distribution
Dans l’organisme, 70% du fer total sont stockés dans les globules rouges sous forme d’hémoglobine, 10 à 20 % sous forme de ferritine et d’hémosidérine et 10% sous forme de myoglobine. Moins de 1% est présent à l’état de trace dans les cytochromes et autres enzymes contenant du fer.
Elimination
La portion de fer non-absorbée est excrétée dans les fèces.
Acide folique
Caractéristiques générales
L’acide folique appartient au groupe B de vitamines. L’acide folique est réduit en tétrahydrofolate in vivo. Le tétrahydrofolate est la coenzyme de divers processus métaboliques, y compris la synthèse des nucléotides de purine et de pyrimidine et donc de la synthèse de l’ADN ; il joue un rôle dans la transformation de divers acides aminés, la formation et l’utilisation de formiate. Une carence entraîne une anémie mégaloblastique.
Absorption
L’acide folique est rapidement absorbé par le tractus gastro-intestinal, principalement par le duodénum et le jéjunum, et est transféré vers la circulation porte sous forme inchangée.
Distribution
Dans le plasma et le foie, il est transformé en 5-méthyltétrahydrofolate, forme métaboliquement active. Les métabolites de folate font l’objet d’une circulation entéro-hépatique. Le folate est excrété dans le lait maternel.
Elimination
Les métabolites excédentaires de folate sont excrétés dans l’urine sous forme inchangée.
5.3. Données de sécurité préclinique
La combinaison du complexe d’hydroxyde ferrique – polymaltose et de l’acide folique est utilisée depuis de nombreuses années dans la pratique clinique en tant qu’anti-anémique, et sa sécurité et son efficacité sont connues.
6. Données pharmaceutiques
6.1. Liste des excipients
Noyau du comprimé : crospovidone, macrogol, povidone, stéarate de magnésium, cellulose microcristalline.
Pelliculage : Opadry II 85F26721 contenant l’alcool polyvinylique, macrogol, dioxyde de titane (E 171), talc, oxyde de fer rouge (E172), oxyde de fer jaune (E172) et laque rouge ponceau 4R (E124).
6.2. Incompatbilités
Aucune incompatibilité connue.
6.3. Stabilité et conditions de conservation
Durée de conservation : 36 mois
Conditions de conservation : Conserver à température ambiante ne dépassant pas 30 °C.
6.4. Précautions particulières de conservation
Sans objet.
6.5. Nature du conditionnement primaire et contenu de l’emballage extérieur
30 comprimés pelliculés sous plaquettes thermoformées PVC/PE/PVDC-Aluminium dans une boîte.
6.6.Précautions particulières d’élimination et manipulation
Pas d’exigences particulières d’élimination et manipulation. Tout produit non-utilisé ou déchet doit être éliminé conformément à la réglementation en vigueur.
7. Inscription à une liste des substances vénéneuses
Liste II.
8. Fabricant
Santa Farma Ilac Sanayi A.S.
GEBKIM Kimya Ihtisas Organize Sanayii Bolgesi
Cerkesli Yolu Üzeri Erol Kiresepi Cad. No: 8, 41455 Dilovasi – KOCAELI, Turquie
9. Titulaire de l’enregistrement
Dafra Pharma GmbH
Mühlenberg 7, 4052 Bâle, Suisse.
10. Date de la dernière révision du texte
Octobre 2019.
Dernière mise à jour de cette page
14/02/2020.